LES MYCOSES OPPORTUNISTES PNEUMOCYSTOSE Définition

LES MYCOSES OPPORTUNISTES
PNEUMOCYSTOSE
Définition
o Infection à pneumocystis jirovecii
o Mycose opportuniste
o Infection pulmonaire grave
Agent pathogène
o Pneumocystis jirovecii : pneumocystic carinii f. sp hominis
o Spécifique de l’homme +++ (cpdt on peut le trouver chez tous les mammifères, cependant les espèces de
pneumocystis varies d’un mammifère à l’autre). Un être humain ne peut donc pas se contaminer à partir d’un
animal
o Champignon atypique (non cultivé en laboratoire)
o Multiplication dans l’alvéole pulmonaire +++
Cycle de réplication :
La forme trophique du champignon est étroitement ancrée sur la surface de l’alvéole pulmonaire. Tout autour, le prolongement
du cytoplasme permet de s’accrocher sur l’alvéole : la perturbation des échanges gazeux va se traduire par une hypoxémie sur le
plan clinique.
Les formes trophiques vont pouvoir
s’enkyster suivant 3 stades : précoce,
intermédiaire puis tardif. Au cours de la
maturation du kyste, les divisions
nucléaires qui vont permettre l’obtention
de 8 corps intrakystiques (noyau +
cytoplasme). La paroi va se rompre,
libération des corps intrakystiques qui
vont s’accrocher sur les alvéoles :
développement.
Le champignon reste en extra cellulaire.
On ne connait pas la durée du cycle par
conséquent le temps d’incubation de la
maladie.
Epidémiologie
o Avant 1980 : cas sporadiques
o 1980 : syndrome d’immunodéficience acquise VIH +++ (facteur favorisant l’émergence)
o Aujourd’hui :
Patients ID, infectés par le VIH si lymphocytes CD4 < 200/mm3, traitement préventif du PPC = maladie
classante car fort risque d’exposition.
Patients soumis à des traitements immunodépresseurs (greffes d’organes) (lymphocytes CD4+ <
300/mm3)
o Infection cosmopolite, régions tempérées +++
o Pas de variation saisonnière
Physiopathologie
o Relation hôte parasite
Primo infection dans l’enfance (<4ans, élimination spontanée)
Pas de portage chronique
Contamination à partir d’une source exogène par contact étroit (pas de contamination endogène de
stade quiescent)
o Source d’infection
Réservoir animal exclu
Réservoir environnemental non identifié

Réservoir de P. jirovecii = sujet infecté +++
o Mode de contamination
Transmission inter humaine par voie aérienne (inhalation)
Stade infectieux non connu
o Multiplication du champignon
Si immunodépression +++
Dans les alvéoles pulmonaires pneumopathie +++
Dissémination rare
o Facteurs prédisposants
Immunodépression acquise
Déficit de l’immunité à médiation cellulaire +++ (lymphocytes CD4+)
Immunodépression congénitale (SCID, hypogammaglobulinémie)
Diagnostic clinique
pneumopathie alvéolo interstitielle chez un patient immunodéprimé
o Signes fonctionnels
Dyspnée +++ (s’aggrave sur 3 a 4 semaines), toux, fièvre
Début insidieux : pour les patients infectés pour le VIH. A l’inverse pour les patients immunodéprimés
non infectés par le VIH, début plus brutal : aggravation de la dyspnée sur 8 a 10 jours : tableau
d’insuffisance respiratoire aigue. Mortalité plus importante pour les patients immunodéprimés sans
VIH
o Signes cliniques
Auscultation pulmonaire normale : toux sèche, peu de fièvre.
Triade dyspnée/toux/fièvre 1 cas sur 2
o Radiographie pulmonaire
Syndrome alvéolo interstitiel bilatéral (TDM : aspect en ‘verre dépoli’)
Signes non spécifiques +++
Diagnostic biologique
o Diagnostic spécifique
Mise en évidence de P. jirovecii dans les prélèvements pulmonaires
Prélèvements : LBA +++ mais reste invasif, produits d’aspiration, expectorations, biopsies
Examen direct : +++ MGG (présence de gros macrophages alvéolaire), imprégnation argentique, bleu
de toluidine, IF
Pas de culture
PCR (autres prélèvements que LBA)
Sérologie : pas d’intérêt
Diagnostic positif = examen direct d’un LBA +++ (uniquement LBA) doit être fait rapidement dans
les 2h.
o Diagnostic non spécifique
Diminution des lymphocytes sanguins CD4+ +++
Augmentation de la lactico déshydrogénase sérique
Diminution de la PaO2 (hypoxie)
NFS : normale ou lymphopénie
Traitement curatif
Les antifongiques sont inactifs, on utilise donc des ATB
o 1ière intention
Bactrim sulfametoxazole + triméthroprime, 21J, IV ou PO
o Alternatives
Welvone 2 semaines, IV (si PaO2 > 60mmHg)
Pentacarinat (pentamidine) 4mg/kg/j, 3 semaines, PO
Cancidas (caspofungine ?)
o Mesures associées
Prednisone si PaO2 < 70mmHg
+/- O2

ventilation mécanique si insuffisance respiratoire
Chambre seule
Traitement prophylactique
o 1ière intention
Bactrim sulfametoxazole + triméthroprime PO
o Alternatives
Disulone + malocide (dapsone + pyriméthamine) PO
Pentacarinat (pentamidine) 4mg/kg/j aérosol
o Prophylaxie primaire
VIH : CD4+ < 200/mm3
VIH- : mal codifié (6 mois post greffe, rejet)
o Prophylaxie secondaire
Arrêt si CD4+ > 200/mm3 2 fois a 3 mois d’intervalle
+++++
LA CRYPTOCOCCOSE
Définition
o Infection a cryptococcus neoformans
o Mycose opportuniste
o Méningo-encéphalite grave, souvent disséminé
Agent pathogène
o Levure capsulée à tropisme neuro méningé
o Variété neoformans : cosmopolite, sol, fientes de pigeons
o Variété gatii : subtropical, eucalyptus
Epidémiologie
o Avant 1980 : cas sporadiques
o 1980 : syndrome d’immunodéficience acquise facteur prédisposant
o Aujourd’hui :
Patients ID, infectés par le VIH si lymphocytes CD4 < 200/mm3, traitement préventif
C’est une maladie classante
Patients soumis à des traitements immunoD
Physiopathologie
o Mode de contamination
Inhalation de la levure +++
Pénètre les alvéoles pulmonaires
Inoculation directe après traumatisme cutané
Pas de transmission inter humaine +++
o Quiescence dans les macrophages alvéolaires
o Multiplication du champignon
Si immunodépression +++
Dissémination sanguine, franchissement de la barrière hémato encéphalique
o Facteurs prédisposants
Immunodépression acquise : déficit de l’immunité à médiation cellulaire, patients infectés par le VIH,
traitements anti diabète
Diagnostic clinique
o Méningo encéphalite torpide chez un patient immunodéprimé
Céphalées, fièvre modérée +++
Vertiges, crise convulsive, paralysie d’un nerf crânien, déficit moteur
Début insidieux +++ (plusieurs semaines)
Mortalité globale 25% (hypertension intracrânienne ou dissémination viscérale)
o Pneumopathie
Signes non spécifiques (toux, expectorations, fièvre modérée)
Asymptomatique (bilan de méningo encéphalite)

Radiographie pulmonaire : syndrome alvéolo interstitiel bilatéral
o Lésions cutanées
Dissémination hématogène (10%) : papules indolores ombiliquées ou ulcérées, sans ADP satellites,
visage et main +++
inoculation directe : lésion unique, aspect de panaris
o Autres localisations
Rénale +++ (VIH+)
Osseuse (os plats, vertèbres)
Hépatique
o Dissémination
Diagnostic paraclinique (bilan minimal)
o LCR (après TDM)
Recherche d’antigènes solubles
Examen direct (encre de chine) et mise en culture sur Sabouraux (1mois)
Cytologie (méningite lymphocytaire)
o Sérum
Recherche d’antigènes solubles
o Hémoculture
o Urines, +/- LBA, +/- biopsie cutanée
Examen direct (encre de chine) et mise en culture sur Sabouraux (1mois)
o Radiographie pulmonaire
Syndrome alvéolo interstitiel
(Sérologie : pas d’intérêt)
Traitement
o Méningo encéphalite
Amphotéricine B (fongizone) + 5 fluorocytosine pour éviter l’apparition des resistants
Relais par azolés
LCR de contrôle (J15 : pronostic)
o Cryptococcose extra méningée
Azolés : per os, fluconazole (triflucan)
Prophylaxie secondaire
per os, fluconazole (triflucan)
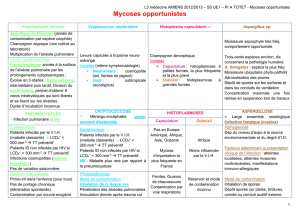
HISTOPLASMOSES
Définition, agents pathogènes
o Infection à Histoplasma capsulatum
o Champignon dimorphique (levure chez humain, filamenteuse en extérieur)
o Variété capsulatum
Histoplasmose à petites formes
La plus fréquente
La plus grave
o Variété duboisii
Histoplasmose à grandes forme
Variété capsulatum
Variété duboisii
Epidémiologie : Pas en Europe, surtout sur le continent
américain, Afrique intertropicale, Afrique du sud, Asie,
Océanie, Guyane, Nouvelle Calédonie
- Mycose opportuniste
- Mycose d’importation la + fréquente (10cas/an)
Réservoir naturel, contamination :
Epidémiologie : pas en Europe, présent en Afrique
Moins influencé par le VIH
Réservoir naturel, contamination : réservoir non connu
Contamination : aérienne ? tellurique ?
Diagnostic clinique : Atteinte pulmonaire (inaperçue le +
souvent)

Fientes d’oiseaux, guanos de chauves souris
Contamination : voie respiratoire, grottes, pigeonniers
Diagnostic clinique : primo infection :
- Asymptomatique (immunocompétent)
- Forme pulmonaire aiguë (infestation importante,
immunodépression, fièvre, toux, dyspnée)
- Forme disséminée : semaines/mois après 1ière
infection
- ID, VIH+++
- Atteintes vasculaires ADN, HMG, SMG
- Ulcères buccaux
Diagnostic biologique : a partir de produits pathologiques
Examen direct : forme petites levures intracellulaire
Culture : forme filamenteuse/culture lente
Traitement : guérison spontanée chez IC
- Forme pulmonaire : Itraconazole 6 à 12 semaines
- Forme disséminée : amphotéricine, relai itraconazole
- Prophylaxie : itraconazole
CD4+ < 150/mm3
En zone d’endémie
Atteinte cutanée : la plus fréquente, papules ombiliquées,
membres, visage
Atteinte sous cutanée : abcès, adénopathies
Atteinte osseuse
Diagnostic biologique : sérosités, adénopathies
Examen direct : forme levure, grandes levures
Culture : forme filamenteuse, culture lente
Traitement : Amphotéricine B
Relais itraconazole pendant 1 an
Drainage chirurgical
Surveillance des rechutes
ASPERGILLOSE
Définition
o Infection par Aspergillus sp
o Large ensemble nosologique (infection fongique invasive +++)
Agent pathogène
o Aspergillus sp : moisissure saprophyte
o 300 espèces environ
o A. fumigatus +++, nidulans, terreus, niger
o Comportement opportuniste
Aspergillus
o Moisissure ubiquitaire, phytopathogène (plantes, terre, débris végétaux)
o Aérosolisation des spores
o Dépôt de spores sur les surfaces, dans les conduits de ventilation
o Concentration maximale si remise en suspension des spores lors des travaux (dépoussiérage, gros œuvre
extérieur)
Pathogénicité : elle dépend :
o Du niveau d’exposition à la source environnementale
o Du degré d’immunodépression des patients
o Facteurs déterminant la présentation clinique de l’infection
Atteintes localisées
Atteintes invasives multi viscérales
Manifestations immuno allergiques
Mode de contamination
o Inhalation de spores atteinte préférentielle des poumons et des VAS
o Dépôts de spores sur des plaies ou brûlures, sur la cornée, le CAE…
Principales manifestations cliniques
o Localisées à l’appareil respiratoire : aspergillome, aspergillome sinusien
o Aspergilloses immuno allergiques : ABPA, asthme, aspergillaire, AAE
o Aspergilloses extra respiratoires : otomycoses, aspergilloses oculaires, aspergilloses cutanées, onyxis
aspergillaires
o Aspergilloses profondes, origine exogène ou diffusion hématogène d’une API
 6
6
 7
7
1
/
7
100%