Télécharger

LYCEE MARIEN N’GOUABI ANNEE SCOLAIRE 2010-2011
DATE : 18/12/2o1o
CLASSE : Tle C
DURRE : 4Heures
Professeur: Mr BAMBARA Devoir de Sciences physiques
A- CHIMIE
Exercice N° 1 :
On réalise différentes solutions en mélangeant à chaque opération une solution aqueuse
d’acide éthanoïque de volume VA et une solution aqueuse d’éthanoate de sodium de volume
Vß. Les solutions d’acide éthanoïque et d’éthanoate de sodium utilisées pour ces mélanges
ont toutes les deux pour concentration C=1ō1mol ℓ-1. Les valeurs du PH de ces solutions
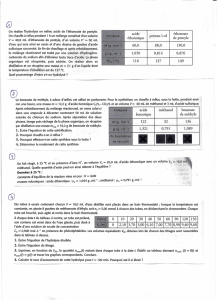
pour différents volumes VA et Vß sont indiquées dans le tableau suivant :
Vß (mol) 10 10 10 10 10 20 30 40 50
VA (mol) 50 40 30 20 10 10 10 10 10
pH 4,1 4,2 4,3 4,5 4,8 5,1 5,3 5,4 5,5
1- On considère que les ions éthanoate sont introduits par la solution d’éthanoate de sodium
et que l’acide n’est pas ionisé. En déduire l’égalité :
3
3
CH COO VB
VA
CH COOH
2- Représentez graphiquement le PH en fonction de
3
3
log CH COO
CH COOH
Echelle 5cm une unité log
3
3
CH COO
CH COOH
et 5cm 1unité de pH
3- Montrer que l’équation de la droite obtenue peut se mettre sous la forme pH=A+B log
3
3
CH COO
CH COOH
4- Calculer à partir de la courbe les valeurs de A et ß. Que représente A ?
5- Calculer les concentrations des différentes espèces chimiques en solution pour PH=5
Exercice N°2
1- Comment obtenir une solution tampon ?
2- Montrer que l’eau pure (pH=7) ne saurait constituer une solution tampon. Pour cela, on
déterminera la variation de PH de l’eau si à un litre de celle-ci, on ajoute, sans variation
sensible de volume, 1ō4 mol d’un acide fort ou d’une base forte
3- Justifier le fait qu’une solution équimolaire de chlorure de sodium et d’acide
chlorhydrique ne constitue pas une solution tampon.
4- Pour obtenir une solution tampon de PH=5 à partir du couple
32
CH CO H
/
32
CH CO
de
pKA =4,8.
a- Trouver le volume Vß d’éthanoate de sodium 1ō2mol ℓ-1, qu’il faut ajouter à 200cm3
d’acide éthanoïque 1ō2mol ℓ-1.

b- Trouver le volume V′B d’hydroxyde de sodium 1ō2mol ℓ-1 qu’il faut ajouter à 200cm3
d’acide éthanoïque 1ō2mol ℓ-1.
PHYSIQUE
Exercice N°1
I) Une bille de masse m est suspendue en un point o par un fil inextensible de longueur
ℓ. On écarte le fil de sa position d’équilibre jusqu'à la position définie par l’angle
o=
;0
OX OM
et on lance la bille dans le plan
,ox oz
avec un vecteur vitesse
O
V
tangent au cercle de rayon ℓ et dirigé vers le bas. On repère la position de la bille par
l’angle
=
,OX OM
O
x
1) exprimer la valeur de la vitesse
V
de la bille, en
fonction des données, à l’instant t.
2) Exprimer la tension T du fil en fonction de
,
O
V
ℓ,
,,
Og
et
m
3)
Exprimer la valeur minimale de
O
V
pour que la bille effectue un tour complet.
II) Le système est mis en mouvement de rotation uniforme autour de l’axe Oz avec une
vitesse angulaire =5rad. Ѕ-1. On donne m=50g, ℓ=50cm et g = 9,8m. S-2.
1. Calculer l’angle
dont le fil s’écarte de l’axe oz.
2. Calculer la tension du fil
EXERCICE N°2
Un cyclotron a un rayon maximal d’extraction Rm=387,5mm. La tension accélératrice à une
valeur maximale de 200kv et une fréquence f = 11,4MHz ;
1) Calculer l’énergie cinétique que possèdent des atomes de carbone quatre fois ionisés à
la sortie de l’appareil. On néglige la vitesse initiale des ions.
2) Calculer la valeur du champ magnétique régnant dans les dêes.
3) Evaluer le nombre de tours effectués par les ions avant leur extraction. Données M
(C4+)=12µ, 1µ=1,67.1ō27kg.
EXERCICE N°3
On considère un condensateur plan formé par deux plaques verticales P1et P2 de longueur
commune ℓ=20cm. Placées à une plan distance d=20cm l’une de l’autre. On applique une
tension U entreP1et P2 créant ainsi un champ électrique
E
’uniforme, horizontal, dirigé de P1
ver P2 de valeur E =2.104V.
1
m
.On apporte ensuite à l’aide d’un fil isolant non chargé une

boule métallisée de masse m =8g possédant une charge q=3.1ō
6
C. Près du bord supérieur de
la plaque positive P1 en O sans toutefois la toucher.
H
Sol
1. Déterminer l’angle
que fait le fil avec la verticale dans cette position d’équilibre.
2. On coupe ensuite le fil, libérant ainsi la boule chargée sans vitesse initiale. Indiquer en la
justifiant la nature du mouvement de la boule à l’intérieur du condensateur. Etablir les
expressions en fonction du temps, y=f(t) et z=f(t) de la trajectoire de la boule dans le plan
(oy,oz) limité par les deux plaques P1 et P2 . En déduire l’équation cartésienne du
mouvement de la boule.
3. Déterminer les coordonnées du point S de la sortie de la boule lorsque celle-ci quitte
l’espace où agit le champ électrique. Calculer la durée t de ce mouvement. Quelle est la
vitesse Vs de la boule à cet endroit ?
4. Sachant que la partie inférieure de ce condensateur se trouve à une hauteur h=25cm du sol,
déterminer les coordonnées du point d’impact J de la boule avec le sol et la valeur de son
vecteur vitesse
g
V
en ce point.
1
/
3
100%