tableaux detaillles college liens seconde

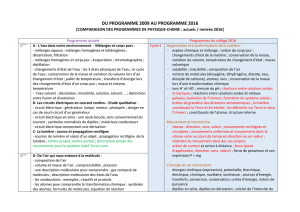
PROGRAMMES de SCIENCES PHYSIQUES au COLLEGE, d’après B.O. 28 Août 2008
Attention, ce tableau détaille plus particulièrement ce qui est nécessaire à une lecture croisée avec le nouveau programme de seconde (2010)
5ème
4ème
3ème
A - L’eau dans notre environnement –
Mélanges et corps purs
MÉLANGES AQUEUX
Mélanges homogènes et hétérogènes
Décantation. Filtration
L’eau peut contenir des gaz dissous
Test de reconnaissance du dioxyde de carbone
MÉLANGES HOMOGÈNES ET CORPS PURS
Mélanges et corps purs
Évaporation
Chromatographie
distillation d’une eau minérale
LES CHANGEMENTS D'ÉTAT DE L'EAU
Les trois états physiques de l'eau
Les changements d'état
Les grandeurs physiques associées : masse volume,
température
L’EAU SOLVANT
Dissolution, miscibilité, solution, corps dissous
(soluté), solvant, solution saturée, soluble,
insoluble, liquides miscibles et non miscibles
------------------------------------------------------------------------------------
B - Les circuits électriques en
courant continu – Étude qualitative
Circuit électrique
Conducteurs et isolants
Sens conventionnel du courant
Montage en série ou avec une dérivation
Court-circuit, électrocution
------------------------------------------------------------------------------------
C - La lumière : sources et
propagation rectiligne
sources primaires ; objets diffusants, vision d’un objet
Propagation rectiligne de la lumière
Modélisation par le rayon lumineux
Les ombres
Description simple des mouvements pour le
système Soleil Terre Lune
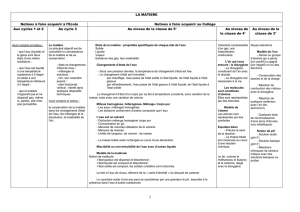
A - De l’air qui nous entoure à la
molécule
COMPOSITION DE L’AIR
VOLUME ET MASSE DE L’AIR
Compressibilité de l’air, pression
Un litre d’air a une masse d’environ un gramme
dans les conditions usuelles de température et
de pression. (Les correspondances simples entre les unités ont
été abordées en cinquième)
UNE DESCRIPTION MOLÉCULAIRE POUR COMPRENDRE
Un gaz est composé de molécules
Les trois états de l’eau et les mélanges à travers la description
moléculaire
LES COMBUSTIONS
Combustions du carbone et butane
Notion de réactifs et de produits. Test CO2
Libération d’énergie
LES ATOMES POUR COMPRENDRE LA
TRANSFORMATION CHIMIQUE
Notion de transformation chimique.
Atomes représentés par des symboles C H O,
molécules par des formules (O2, H2O, CO2,
C4H10 et/ou CH4).
Equation de réaction des combustions étudiées
Conservation de la masse et des atomes
------------------------------------------------------------------------------------
B - Les lois du courant continu
Intensité, ampèremètre, tension, voltmètre
Branches, nœuds, lois (unicité, additivité)
Résistance, loi d’Ohm
------------------------------------------------------------------------------------
C. La lumière : couleurs, images,
vitesse
LUMIERES COLORÉES ET COULEUR DES OBJETS
Spectre continu par décomposition de la lumière
blanche en utilisant un prisme ou un réseau
Filtre en lumière blanche, absorption
Synthèse additive
QUE SE PASSE-T-IL QUAND LA LUMIERE TRAVERSE UNE
LENTILLE ?
Lentilles minces, convergentes, divergentes : foyers et images
L’œil, les verres correcteurs
VITESSE DE LA LUMIERE
Propagation de la lumière dans le vide et les
milieux transparents
Vitesse de la lumière dans le vide (3 × 108 m/s
ou 300 000 km/s)
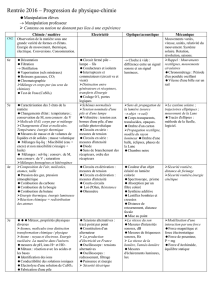
A - La chimie, science de la
transformation de la matière
CONDUCTION ELECTRIQUE
1-Conduction électrique et structure de la matière
dans les métaux : l’électron et dans les solutions : l’ion
Constituants de l’atome : noyau et électrons.
Structure lacunaire de la matière.
Atomes et molécules électriquement neutres ; électron et
ions chargés électriquement.
2- Tests de quelques ions : Na+, Cl-, Cu2+, Fe2+ et Fe3+.
Solutions neutres, acides et basiques. Ions H+ et HO-
3- Réaction entre le fer et l’acide chlorhydrique
Critères de reconnaissance d’une transformation
chimique : disparition des réactifs et apparition de produits.
(équation écrite en toutes lettres)
4- Pile électrochimique et énergie chimique
SYNTHÈSE D’ESPÈCES CHIMIQUES (naturelles ou
artificielles)
------------------------------------------------------------------------------------
B - ÉNERGIE ÉLECTRIQUE ET
CIRCUITS ÉLECTRIQUES EN «
ALTERNATIF »
DE LA CENTRALE A L UTILISATEUR
Production de l’électricité
L’alternateur
Tension alternative périodique – valeur max et min
Oscilloscope ou boîtier d’acquisition avec ordi. Période,
fréquence, tension sinusoïdale
Valeur efficace de la tension
PUISSANCES ET ENERGIE EFFICACES
P = UI et E = Pt, Joules
------------------------------------------------------------------------------------
C - De la gravitation … à l’énergie
mécanique
INTERACTION GRAVITATIONNELLE
Présentation succincte du système solaire.
Notion de gravitation
Poids et masse d’un corps. P = mg
Energie de position, énergie cinétique, énergie mécanique.
ENERGIE CINETIQUE ET PREVENTION ROUTIERE
solide en translation : Ec = ½ m.v2. Unité : joules (J).
(notion de vitesse ayant déjà été abordée en mathématiques
en classe de quatrième)

PROGRAMMES de SCIENCES PHYSIQUES au COLLEGE, d’après B.O. 28 Août 2008
Attention, ce tableau détaille plus particulièrement ce qui est nécessaire à une lecture croisée avec le nouveau programme de seconde (2010)
en jaune : ce qui va être réutilisé en seconde
5ème
4ème
3ème
A - L’eau dans notre environnement –
Mélanges et corps purs
MÉLANGES AQUEUX
Mélanges homogènes et hétérogènes
Décantation. Filtration
L’eau peut contenir des gaz dissous
Test de reconnaissance du dioxyde de carbone
MÉLANGES HOMOGÈNES ET CORPS PURS
Mélanges et corps purs
Évaporation
Chromatographie
distillation d’une eau minérale
L’introduction de la molécule comme entité chimique
est reportée en classe de quatrième. Ceci n’exclut pas
que le professeur, s’il le juge pertinent, utilise dès la
classe de cinquième la notion de molécule pour éclairer
celle de corps pur .Le concept d’ion n’est abordé qu’en
classe de troisième.
LES CHANGEMENTS D'ÉTAT DE L'EAU
Les trois états physiques de l'eau
Les changements d'état
Les grandeurs physiques associées : masse, volume,
température
L’EAU SOLVANT
Dissolution, miscibilité, solution, corps dissous
(soluté), solvant, solution saturée, soluble,
insoluble, liquides miscibles et non miscibles
------------------------------------------------------------------------------------
B - Les circuits électriques en
courant continu – Étude qualitative
Circuit électrique
Conducteurs et isolants
Sens conventionnel du courant
Montage en série ou avec une dérivation
Court-circuit, électrocution
------------------------------------------------------------------------------------
C - La lumière : sources et
propagation rectiligne
sources primaires ; objets diffusants, vision d’un objet
Propagation rectiligne de la lumière
Modélisation par le rayon lumineux
Les ombres
Description simple des mouvements pour le
système Soleil Terre Lune
A - De l’air qui nous entoure à la
molécule
COMPOSITION DE L’AIR
VOLUME ET MASSE DE L’AIR
Compressibilité de l’air, pression
Un litre d’air a une masse d’environ un gramme
dans les conditions usuelles de température et
de pression. (Les correspondances simples entre les unités ont
été abordées en cinquième)
UNE DESCRIPTION MOLÉCULAIRE POUR COMPRENDRE
Un gaz est composé de molécules
Les trois états de l’eau et les mélanges à travers la description
moléculaire
LES COMBUSTIONS
Combustions du carbone et butane
Notion de réactifs et de produits. Test CO2
Libération d’énergie
LES ATOMES POUR COMPRENDRE LA
TRANSFORMATION CHIMIQUE
Notion de transformation chimique.
Atomes représentés par des symboles C H O,
molécules par des formules (O2, H2O, CO2,
C4H10 et/ou CH4).
Equation de réaction des combustions étudiées
Conservation de la masse et des atomes
------------------------------------------------------------------------------------
B - Les lois du courant continu
Intensité, ampèremètre, tension, voltmètre
Branches, nœuds, lois (unicité, additivité)
Résistance, loi d’Ohm
------------------------------------------------------------------------------------
C. La lumière : couleurs, images,
vitesse
LUMIERES COLORÉES ET COULEUR DES OBJETS
Spectre continu par décomposition de la lumière
blanche en utilisant un prisme ou un réseau
Filtre en lumière blanche, absorption
Synthèse additive
QUE SE PASSE-T-IL QUAND LA LUMIERE TRAVERSE UNE
LENTILLE ?
Lentilles minces, convergentes, divergentes : foyers et images
L’œil, les verres correcteurs
VITESSE DE LA LUMIERE
Propagation de la lumière dans le vide et les
milieux transparents
Vitesse de la lumière dans le vide (3 × 108 m/s
ou 300 000 km/s)
A - La chimie, science de la
transformation de la matière
CONDUCTION ELECTRIQUE
1-Conduction électrique et structure de la matière
dans les métaux : l’électron et dans les solutions : l’ion
Constituants de l’atome : noyau et électrons.
Structure lacunaire de la matière.
Atomes et molécules électriquement neutres ; électron et
ions chargés électriquement.
2- Tests de quelques ions : Na+, Cl-, Cu2+, Fe2+ et Fe3+.
Solutions neutres, acides et basiques. Ions H+ et HO-
3- Réaction entre le fer et l’acide chlorhydrique
Critères de reconnaissance d’une transformation
chimique : disparition des réactifs et apparition de produits.
(équation écrite en toutes lettres)
4- Pile électrochimique et énergie chimique
SYNTHÈSE D’ESPÈCES CHIMIQUES (naturelles ou
artificielles)
------------------------------------------------------------------------------------
B - ÉNERGIE ÉLECTRIQUE ET
CIRCUITS ÉLECTRIQUES EN «
ALTERNATIF »
DE LA CENTRALE A L UTILISATEUR
Production de l’électricité
L’alternateur
Tension alternative périodique – valeur max et min
Oscilloscope ou boîtier d’acquisition avec ordi. Période,
fréquence, tension sinusoïdale
Valeur efficace de la tension
PUISSANCES ET ENERGIE EFFICACES
P = UI et E = Pt, Joules
------------------------------------------------------------------------------------
C - De la gravitation … à l’énergie
mécanique
INTERACTION GRAVITATIONNELLE
Présentation succincte du système solaire.
Notion de gravitation
Poids et masse d’un corps. P = mg
Energie de position, énergie cinétique, énergie mécanique.
ENERGIE CINETIQUE ET PREVENTION ROUTIERE
solide en translation : Ec = ½ m.v2. Unité : joules (J).
(notion de vitesse ayant déjà été abordée en mathématiques
en classe de quatrième)
1
/
2
100%