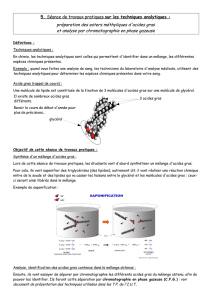
Biochimie métabolique: les lipides Les lipides plasmatiques chez le

Biochimie métabolique: les lipides
Les lipides plasmatiques chez le sujet sain:
• Présents sous la forme d'association polymoléculaires:
- Lipides (plusieurs structures différentes).
- Protéines (apolipoprotéines).
L'ensemble forme les lipoprotéines.
• Concentrations plasmatiques:
- Cholestérol total: 60 % 4 – 7 mmol/l (1,5 – 2,6 g/l)
- Phospholipides totaux: 25 % 2 – 4 mmol/l (1,5 – 3 g/l)
- Triglycérides: 10 % 0,6 – 1,6 mmol/l (0,5 – 1,5 g/l)
- Acides gras non estérifiés: 5 % 0,3 – 0,8 mmol/l (0,15 – 0,40 g/l)
Cf diapo 1
Les sels biliaires sont les produits du catabolisme du cholestérol.
Autres protéines impliqués dans le métabolisme des lipides:
Protéines plasmatiques:
- Cholesterol Ester Transfert Protein (CETP): transfert des lipides neutres (triglycérides et
esters de cholestérol), phospholipides.
- Phospholipid Transfert Protein (PLTP): transfert des phospholipides, transformation des
HDL3 en HDL2.
C'est un système dynamique.
Rappels de structure des acides gras:
• Nombre de carbones (pair en général):
- Acides gras courts: C4 – C6.
- Acides gras moyens: C8, C10, C12.
- Acides gras longs: C14, C16, C18.
- Acides gras très longs: C20, C22, C24.
• Double(s) liaison(s):
- A partir du COOH (officielle): Δ-cis n1, n2, … nn.
- A partir du CH3 (courante): (n – x) ou ωx.
Distance entre 2 doubles liaisons: 3 carbones (non conjuguées).
Cf diapo 2
Catabolisme des acides gras:
- Se fait dans la plupart des cellules sauf les glucodépendantes et nerveuses.
- Localisation mitochondriale exclusivement.
- Production d'acétyl CoA, NADH, H+ et FADH2 → énergie cellulaire.
- Métabolisme hépatique important en période de jeûne après lipolyse adipocytaire.
- Transport des AGNE (et non acides gras « libres ») par l'albumine.
- Après entrée cellulaire: activation puis passage intra-mitochondrial.
Lipolyse → acides gras (AG) (chaîne longue C16 – C18).
1. Activation: CoASH + ATP + AG → Acyl-CoA + ADP + Pi
2. Transport intra-mitochondrial:
C12 – C18: passage à l'aide de la carnitine.
< C12: passage simple.

> C20: oxydation initiale peroxysomale jusqu'en C12.
3. Oxydation (β-oxydation, hélice de Lynen).
Acyl: acides gras quelque soit son nombre de carbone ou s'il est saturé ou insaturé.
Cf diapo 3
Le transfert de l'acyl sur la carnitine ne nécessite pas d'énergie. Il y a ensuite action d'une autre
enzyme (carnitine-acylcarnitine translocase) pour faire passer l'acyl-carnitine à travers la membrane
mitochondriale interne. C'est un système à double sens (entrée d'acyl-carnitine et sortie de
carnitine).
• Si concentrations élevées:
- Inhibition de la CPT.
- Augmentation synthèse des acides gras.
- Diminution du catabolisme des acides gras.
• Si concentrations faibles:
- Activation de la CPT.
- Diminution de la synthèse des acides gras.
- Augmentation du catabolisme des acides gras.
• Étapes de la β-oxydation:
Action d'une déhydrogénase (formation d'une double liaison) → FADH2.
Action d'une crotonase (hydratation de la double liaison).
Action d'une déhydrogénase → NADH, H+.
Clivage → AcétylCoA.
A chaque fois qu'on fait un tour, on coupe la molécule de 2 carbones.
Cf diapo 4
Bilan énergétique de la β-oxydation (moles d'ATP produites):
Exemple de l'acide stéarique (C18:0)
Consommation:
1 ATP (activation acide gras en AcylCoA) = - 1
Production:
9 AcétylCoA → Cycle de Krebs 12 x 9 = 108
8 FADH2 2 x 8 = 16
→ chaîne respiratoire
8 NADH, H+ 3 x 8 = 24
Total = 147
Cas des acides gras insaturés: - 1 FADH2 par double liaison (pas d'étape n°1).
Rendement = 0,52 moles d'ATP par gramme d'acide stéarique.
Pour mémoire: 1 g de glucides = 0,21 moles d'ATP.
1 g de protéines = 0,26 moles d'ATP.
Synthèse des acides gras:
Exclusivement cytosolique au niveau hépatique (lipogénèse).
Variations selon les apports alimentaires (apports > consommation).
• Sources d'acétylCoA:
- Glucides (glycolyse ... pyruvate ... acétylCoA).
- Aminoacides (partie métabolique carboné):
Leu, Ile, Lys, Trp.
- Alcool (alcool ... acétate ... acétylCoA) (foie uniquement)
(alcool ... acides gras ... triglycérides ... obésité).

• Autres substrats nécessaires:
- NADPH, H+ (navette citrate – malate – pyruvate, pentoses phosphates).
- Biotine (acétylCoAcarboxylase ... malonylCoA).
- Complexe multienzymatique (acide gras synthase).
• Structure de l'acide gras synthase:
Cf diapo 5
Division structurale vs division fonctionnelle.
Il y a 2 sous-unités identiques qui ne marchent pas, d'un point de vue fonctionnel, sur le même
canevas.
• Mécanisme biochimique (hélice de Wakil):
Cf diapo 6
C'est un système ascendant.
La consommation d'une molécule d'ATP est rendue nécessaire car on va ajouter une molécule de
CO2 (acétylCoA carboxylase qui nécessite la présence de biotine). On obtient une molécule de
malonylCoA qui va entrer dans le complexe multienzymatique de l'acide gras synthase, pour former
un palmitylCoA (acide gras en C16).
• Processus alternatif élongation – désaturation: synthèse acides gras insaturés:
Cf diapo 7
L'organisme n'est pas capable de passer d'un acide stéarique (C18:0) à un acide oléique (C18:1). Il
faut passer par des acides gras essentiels (acides gras qui ne peuvent pas être synthétisés par
l'organisme).
Il y a un mécanisme de désaturation et d'élongation qui permet de fabriquer des acides gras
polyinsaturés avec un nombre d'insaturation plus important.
• Bilan énergétique:
Exemple avec le palmitate (C16:0):
8 acétylCoA + 7 ATP + 14 NADPH, H+
palmitate + 14 NADP+ + 8 CoASH + 6 H2O + 7 ADP + 7 Pi
Comparaison des deux voies métaboliques:
Cf diapo 8 & 9
Régulation du métabolisme des acides gras (hépatocyte – plasma – adipocyte)
Cf diapo 10
Albumine: transporteur polyvalent des composés hydrophobes, notamment des acides gras.
Régulation de la carboxylase: - en vert → stimulation (insuline).
- en rouge → inhibition (glucagon).
Dualité de régulation:
• Phase post-prandiale (après un repas): réduction du catabolisme, augmentation des synthèses.

(apports glucidiques)
• Phase inter-prandiale (entre les repas): augmentation catabolisme, réduction des synthèses.
(sans apports glucidiques)
• Implication de multiples facteurs: nutritionnels, hormonaux, allostériques.
• Exemple avec le malonylCoA (synthèse des acides gras).
Rôle du malonylCoA (synthèse par acétylCoA carboxylase + biotine):
En fonction des concentrations cytosoliques, ça oriente vers l'une ou l'autre des réactions.
Fortes concentrations
Faibles concentrations
Inhibition de la CPT
Activation de la CPT
Réduction passage acides gras
Augmentation passage acides gras
Réduction de la β-oxydation
Augmentation de la β-oxydation
Augmentation synthèse acides gras
Réduction synthèse acides gras
→ Le malonylCoA est un effecteur à double sens.
CPT: Carnitine Palmitoyl Transférase.
Régulation du métabolisme des acides gras:
[glucose] → insuline – glycolyse → acétylCoA
↓
synthèse d'acides gras et ← malonylCoA ← citrate
diminution β-oxydation
Régulation enzymatique:
- Enzymes actives: formes déphosphorylées.
- Enzymes inactives: formes phosphorylées.
(analogie avec la glycogène synthase).
• Période inter-prandiale (entre les repas):
[Glucose] réduite: - ralentissement glycolyse et oxydation mitochondriale.
- diminution de [malonylCoA].
- réduction de la synthèse d'acides gras.
- augmentation de la lipolyse.
- augmentation de la β-oxydation (CPT).
- production (éventuelle) de corps cétoniques.
• Régulation enzymatique:
- Enzymes actives: formes phosphorylées.
- Enzymes inactives: formes déphosphorylées.
(analogies avec les phosphorylases dans la glycogènolyse).
Modifications chimiques des acides gras:
Cf diapo 11
La peroxydation lipidique a une implication sur le risque cardio-vasculaire. La peroxydation
lipidique est exclusivement réservée aux acides gras insaturés.
RLO: Radicaux Libres de l'Oxygène qui sont souvent issus du mécanisme du stress oxydatif.
Cf diapo 12

En temps ordinaire, les radicaux libres existent. Le stress oxydatif est un déséquilibre entre pro-
oxydants et antioxydants.
Cétogénèse et cétolyse:
• Définition: molécules à 4 carbones, très diffusibles dans le sang et tissus périphériques (« lipides
hydrosolubles »).
Acétoacétate, 3β-OH butyrate (et acétone d'importance secondaire).
Cf diapo 13
• Synthèse:
Mitochondries hépatiques en période de jeûne (exclusivement).
(Abondance d'acétylCoA: lipolyse et β-oxydation ou acides aminés cétogènes).
Acides aminés cétogènes: - Ile donne acétylCoA.
- Trp et Lys donnent acétoacétylCoA.
- Leu donne HMGCoA.
- Phe et Tyr donnent acétoacétate.
Acétone: décarboxylation spontanée de l'acétoacétate en excès (non enzymatique) – élimination
respiratoire.
Cf diapo 14 & 15
Dérivés des acides gras:
• Les eicosanoïdes
Cf diapo 16
Rappel du processus d'élongation et de désaturation des acides gras.
Voie linéaire d'utilisation de l'acide arachidonique:
Cf diapo 17
Voie cyclique d'utilisation de l'acide arachidonique:
Cf diapo 18
La première étape de cyclisation est inhibée par l'aspirine.
Devenir de l'acide arachidonique:
Cf diapo 19
Catabolisme des prostaglandines → obtention d'acides dicarboxyliques urinaires.
Le dosage des acides dicarboxyliques urinaires peut être un reflet du catabolisme des
prostaglandines.
Synthèse des leucotriènes:
Cf diapo 20
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%