ELABORATION DE L`ALUMINIUM SEPARATION D`IONS

TP
χ
χχ
χ
ELABORATION DE L'ALUMINIUM
SEPARATION D'IONS
BUT
: • Mettre en évidence l'influence du pH sur la précipitation des hydroxydes
métalliques
• Illustrer le principe de précipitation sélective
• Comprendre les différentes étapes de l'élaboration de l'aluminium
1. Aperçu historique :
Le métal aluminium n'existe pas dans la nature. L'élément aluminium est cependant, en
importance, le troisième élément de la croûte terrestre (proche de 8 %). Il y est présent
essentiellement sous forme d'oxyde d'aluminium.
L’industrie de l’aluminium date de la fin du Second Empire. C’est à cette époque, grâce à un
procédé mis au point par le chimiste Henri Sainte Claire Deville que se crée, en 1860, à Salindres
(dans le Gard) la première unité au monde de fabrication de l’aluminium (exclusivité qui sera
conservée pendant près de 30 ans). L’aluminium devient alors un symbole du progrès industriel,
ainsi lors d’un banquet impérial, seul Napoléon III a droit d’utiliser des couverts en aluminium,
les autres convives doivent se contenter de couverts … en argent !
Depuis l’utilisation de l’aluminium s’est diversifiée et démocratisée même si par les quantités
d’énergie qu’il met en œuvre pour son élaboration (utilisation de l’électrolyse) l’aluminium reste
un métal plutôt cher.
Le minerai le plus utilisé pour produire l'aluminium est la Bauxite (les premiers gisements
furent découverts dans le village des Baux-de-Provence en 1831 par Pierre Berthier qui était
minéralogiste et ingénieur de mines). A partir de la bauxite, on produit l'alumine (Al
2
O
3
) dont
l'électrolyse à l'état fondu permet d'obtenir l'aluminium.
Les principaux minerais de bauxite exploités aujourd’hui sont situés en Australie, Jamaïque,
Guinée et Brésil. La bauxite ne contient pas que de "l'aluminium", on y trouve 40 à 60 % en
masse d'alumine sous forme hydratée Al(OH)
3
, mais également 10 à 20 % d'oxyde de fer II
hydraté Fe(OH)
3
et aussi de la silice. Il faut donc pouvoir séparer l'alumine des autres constituants
du minerai. Les expériences suivantes illustrent ce procédé
2. Séparation des ions aluminium et fer
2.1. Ions aluminium et soude
Dans un bécher verser 20 mL (mesurés à l'éprouvette) d'une solution (acidifiée) de sulfate
d'aluminium (Al
2
(SO
4
)
3
) de concentration c
1
= 5,0×10
-2
mol.L
-1
.
Ajouter goutte à goutte, à l'aide de la burette et en agitant constamment, une solution de soude
de concentration c
b
= 2,0 mol.L
-1
.
Observer en continu l'aspect de la solution. Lorsqu'un précipité apparaît, mesurer le pH de la
solution (au papier pH) : pH
1
≈
Continuer à ajouter la solution de soude et poursuivre les observations. Lorsque la solution
redevient limpide, mesurer le pH : pH
2
≈
Ajouter alors, avec précaution et en maintenant l’agitation, une solution d'acide chlorhydrique
de concentration c
a
= 3,0 mol.L
-1
.
Observer et noter les évolutions du mélange réactionnel.

Dans les calculs qui suivent, on néglige les effets de la dilution liée à l'ajout de la soude.
2.1.1. Ecrire l'équation de dissolution du sulfate d'aluminium dans l'eau.
2.1.2. En déduire la concentration initiale des ions aluminium [Al
3+(aq)
]
0
dans la solution.
2.1.3. Ecrire l'équation de la réaction conduisant à la formation du précipité d'hydroxyde
d'aluminium.
2.1.4. La constante d'équilibre de la réaction précédente étant K
1
= 1,0
×
10
32
, déterminer le pH
de début de précipitation de Al(OH)
3(s)
. Comparer à la valeur expérimentale.
2.1.5. En présence d'un excès d'ions hydroxyde, il se forme l'ion hydroxyaluminate Al(OH)
4
−
(aq)
.
Ecrire l'équation de la réaction correspondante.
2.1.6. Montrer que lorsque tout le précipité disparaît [Al(OH)
4
−
(aq)
] = [Al
3+(aq)
]
0
2.1.7. La constante d'équilibre de la réaction précédente étant K
2
= 10, déterminer le pH de
disparition du précipité Al(OH)
3(s)
. Comparer à la valeur expérimentale.
2.1.8. Sur un axe gradué en pH, placer les deux valeurs précédentes et ajouter les espèces
présentes selon le domaine de pH.
2.1.9. Interpréter alors les observations effectuées lors de l'ajout de la solution acide.
2.2. Ions fer et soude
Dans un bécher verser 20 mL (mesurés à l'éprouvette) d'une solution (acidifiée) de chlorure de
fer III (FeCl
3
) de concentration c
2
= 2,0×10
-2
mol.L
-1
.
Ajouter goutte à goutte, à l'aide de la burette et en agitant constamment, une solution de soude
de concentration c
b
= 2,0 mol.L
-1
.
Observer en continu l'aspect de la solution. Lorsqu'un précipité apparaît, mesurer le pH de la
solution (au papier pH) : pH
3
≈
Continuer à ajouter la solution de soude et poursuivre les observations
Ajouter alors, avec précaution et en maintenant l’agitation, une solution d'acide chlorhydrique
de concentration c
a
= 3,0 mol.L
-1
.
Observer et noter les évolutions du mélange réactionnel.
2.2.1. Ecrire l'équation de dissolution du chlorure de fer III dans l'eau.
2.2.2. En déduire la concentration initiale des ions fer III [Fe
3+(aq)
]
0
dans la solution.
2.2.3. Ecrire l'équation de la réaction conduisant à la formation du précipité d'hydroxyde de fer
III.
2.2.4. La constante d'équilibre de la réaction précédente étant K
3
= 1,0
×
10
38
, déterminer le pH
de début de précipitation de Fe(OH)
3(s)
. Comparer à la valeur expérimentale.
2.2.5. Sur un axe gradué en pH, placer la valeur précédente et ajouter les espèces présentes selon
le domaine de pH.
2.2.6. Interpréter alors les observations effectuées lors de l'ajout de la solution acide.
2.3. Séparation des ions
Dans un bécher verser 10 mL (mesurés à l'éprouvette) d'une solution (acidifiée) de sulfate
d'aluminium (Al
2
(SO
4
)
3
) de concentration c
1
= 5,0×10
-2
mol.L
-1
et 10 mL (mesurés à l'éprouvette)
d'une solution (acidifiée) de chlorure de fer III (FeCl
3
) de concentration c
2
= 1,0×10
-1
mol.L
-1
.
Ajouter goutte à goutte, à l'aide de la burette et en agitant constamment, une solution de soude
de concentration c
b
= 2,0 mol.L
-1
jusqu'à atteindre un pH voisin de 13
Filtrer la solution
Observer la couleur du solide et celle du filtrat. Commenter.
Verser un peu du filtrat dans un tube à essai.
Y ajouter quelques gouttes de thiocyanante de potassium (KSCN). Observer.
2.3.1. Que peut-on déduire du dernier test effectué ?
2.3.2. Justifier ce résultat

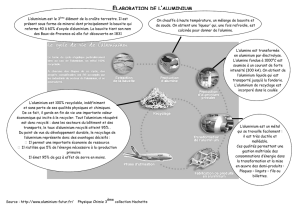
3. La préparation industrielle de l’aluminium
3.1. De la bauxite à l’alumine
Industriellement, on utilise le procédé mis au point par Karl-Joseph Bayer en 1887. Ce procédé
(dit procédé Bayer) exerce un quasi-monopole sur la production mondiale d’alumine (mais il
n’est applicable qu’à la bauxite et pas aux autres minerais d’aluminium)
Etape 1 : le minerai de bauxite, de couleur rouge, est concassé puis finement broyé.
Etape 2 : La poudre obtenue est mélangée à de la soude (liqueur d’attaque). L’ensemble est
maintenu sous pression (de 20 à 40 bars) ce qui permet une élévation de la température jusqu’à
250 °C (à la pression normale, il aurait ébullition). On obtient alors une suspension (mélange de
solution et de fines particules solides).
Etape 3 : La suspension est refroidie et diluée ce qui favorise la décantation des boues
résiduelles appelées boues rouges. Celles-ci, sans valorisation possible, sont alors lavées puis
déversées dans la mer ou stockées dans des sites appropriés.
Après décantation, on récupère la ‘‘liqueur’’ (solution) puis pour éliminer au maximum les
impuretés insolubles, elle est filtrée sous pression et à chaud.
Le filtrat est ensuite ramené à température ambiante.
Etape 4 : La précipitation de l’alumine hydratée contenue dans la liqueur est provoquée par
l’ajout d’une quantité importante d’alumine qui joue le rôle d’amorce.
On peut pour simplifier modéliser cette étape par une ‘‘attaque’’ acide de la liqueur issue de la
décantation (Etape 3).
Etape 5 : Une filtration est effectuée pour récupérer l’alumine hydratée (dont une partie est
recyclée à l’étape 4).
Etape 6 : L’alumine hydratée obtenue à l’étape précédente est introduite dans des fours (900 à
1 000 °C) où elle est calcinée. On obtient alors l’alumine anhydre Al
2
O
3
qui se présente sous la
forme d’un solide blanc.
La production d’une tonne d’alumine nécessite : 2,5 tonnes de bauxite
120 kg de soude
7 tonnes d’eau
2 000 kWh
3.1.1. Pourquoi fait-on réagir la bauxite avec de la soude (Etape 2) ?
3.1.2. De quoi sont essentiellement constituées les boues rouges (Etape 3) ? Justifier leur nom.
3.1.3. Pourquoi provoque-t-on une ‘‘attaque acide’’ de la liqueur ?
3.1.4. justifier la filtration de l’étape 5.
Bauxite
Alumine

3.2. De l’alumine à l’aluminium
Le procédé de Saint Claire Deville est rapidement supplanté par un procédé électrolytique mis
au point en 1886 par le Français Paul Héroult (et quasi simultanément par Charles Martin-Hall
aux Etats-Unis). Ce procédé fut proposé à Alfred Rangold dit « Péchiney » directeur de l’usine de
Salindres par Héroult lui-même, mais Péchiney ne fut pas séduit…
L’alumine est électrolysée pour donner naissance à l’aluminium. Cependant la température de
fusion de l’alumine égale à 2 040°C empêche son utilisation pure. Il faut donc y adjoindre un
fondant qui permet d’abaisser cette température. Le fondant utilisé est de la cryolithe AlF
3
, 3 NaF
(extrait de mines au Groenland ou fabriquée industriellement).
Les cuves à électrolyse (voir schéma) sont donc remplies avec un mélange constitué de 5 %
d’alumine, de 83 % de cryolithe et également de 7 % de fluorure d’aluminium et 5 % de fluorure
de calcium. La température du
mélange à l’état liquide est
comprise entre 940°C et 980°C.
Cette température est maintenue
grâce à la chaleur dégagée par
l’électrolyse (effet Joule). Dans le
bain en fusion l’alumine est sous
la forme d’ions Al
3+
et O
2−
.
Dans les conditions normales,
l'électrolyse ne présente pas de
réaction parasite (il faut
néanmoins que la teneur en
alumine soit supérieure à 1,5 %)
L'aluminium formé, de densité
2,35, se dépose au fond de la cuve
et est ainsi protégé de l'air
ambiant. Il est ensuite siphonné et transporté à l'état liquide jusqu'à la fonderie. L'aluminium ainsi
produit a un degré de pureté de l'ordre de 99,5 %. Le rendement de l'électrolyse (masse
d'aluminium obtenue sur masse théoriquement possible), lui, est d'environ 95 %.
L'intensité du courant dans l'électrolyseur est de l'ordre de 300 kA, la tension aux bornes d'une
cuve est de 4,0 V. Une usine d'électrolyse de l'aluminium peut comporter jusqu’à 250 cuves
montées en série.
Le carbone de l'anode doit être régulièrement renouvelé.
La production d'une tonne d'aluminium nécessite : 2 tonnes d'alumine
400 kg de carbone
60 kg de cryolithe
13 000 kWh
3.2.1. Pourquoi faut-il que le contenu des cuves soit à l'état liquide ?
3.2.2. Quels ions peuvent réagir à la cathode ? Ecrire l'équation correspondante. S'agit-il d'une
oxydation ou d'une réduction ?
3.2.3. Quels ions peuvent réagir à l'anode? Ecrire l'équation correspondante. S'agit-il d'une
oxydation ou d'une réduction ?
3.2.4. En déduire ce que pourrait être le bilan de l'électrolyse de l'alumine.
3.2.5. Que peut-on supposer de la densité du mélange fondu alumine-cryolithe ?
3.2.6. Pourquoi l'aluminium déposé au fond de la cuve n'empêche-t-il pas la poursuite de
l'électrolyse ?
3.2.7 Que peut-il se passer à l'anode qui justifie la consommation des électrodes en carbone et
donc leur remplacement régulier ou progressif ?
3.2.8. Les valeurs des tonnages données sont-elles en accord avec le rendement annoncé de
l'électrolyse ?
Alimentation en alumine
Evacuation
des gaz
anode
alumine et
cryolithe
capot
aluminium
cathode
1
/
4
100%