physiologie renale

CAPET Civel Cédric Physiologie rénale Page 1 sur 17
PHYSIOLOGIE RENALE : Première partie (anatomie et fonctionnement)
La composition du milieu intérieur est soumise à de nombreuses variations. En effet, l’apport irrégulier de nutriments et la
production irrégulière de déchets métaboliques dus à l’activité physique influencent la composition du milieu intérieur. Or, l’organisme
a besoin de maintenir un contrôle strict de la composition du milieu intérieur.
La fonction principale des reins est donc de garantir l’homéostasie du milieu intérieur. Pour cela, les reins régulent la
composition du sang et donc la composition de l’ensemble des liquides extracellulaires. La production d’une urine de composition
variable est donc un élément indispensable à l’homéostasie.
L’excrétion a donc deux rôles clés : l’élimination des déchets métaboliques azotés, le maintien de l’homéostasie (maintien
de la composition du milieu intérieur, de la pression artérielle et de son pH).
Homéostasie : le but du rein est l’élimination de substances et de l’eau (poumons, glandes sudoripares).
Remarque : le rein à également une fonction endocrine : production du métabolite rénal de la vitamine D (1,25(OH)2D3), hormone qui contrôle l’absorption
digestive du calcium et intervient dans le métabolisme osseux, et production de l’érythropoïétine, glycoprotéine contrôlant l’érythropoïèse.
I. ANATOMIE DE L’APPAREIL URINAIRE
I.1. Organisation de l’appareil urinaire
I.1.1. Présentation de l’appareil urinaire
Situation dans l’organisme, glandes surrénales (sans rapport),
miction (dans le Ganon et Marieb)
I.1.2. Organisation de l’appareil urinaire
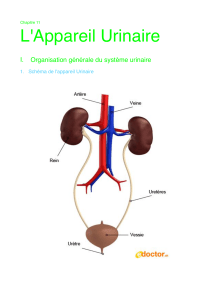
L’appareil urinaire est composé : de 2 reins qui élaborent l’urine,
de 2 uretères qui transportent l’urine des reins à la vessie, de la
vessie qui stocke de l’urine entre les 2 mictions, d’une urètre qui
permet l’émission de l’urine.
Remarque : les glandes surrénales n’ont pas de rapport
physiologique avec l’appareil urinaire.
I.2. Organisation anatomique du rein
I.2.1. Présentation générale du rein
Ce sont des organes bruns rouges en forme de haricot (150 g
chacun). On distingue 2 zones : zone corticale ou cortex :
aspect finement granuleux. Et la zone médullaire ou
médulla : aspect strié formé de 8 à 12 zones coniques
nommées pyramides de Malpighi.
La collecte de l’urine se fait depuis les calices qui reçoivent
l’urine provenant des pyramides de Malpighi. Elle est
déversée dans le bassinet, parvient dans la vessie via les 2
uretères.
Pour assurer leur rôle de régulation du milieu
intérieur, les reins reçoivent une vascularisation importante
à partir de l’aorte abdominale, via l’artère rénale. Le sang
épuré ressort par la veine rénale.
(+Anatomie externe, interne…)
Débit sanguin rénal : Les reins sont des organes qui représentent 0,5 % de la masse corporelle mais qui reçoivent 25 % du débit cardiaque (1,2-1,3 L/minute). Les
reins sont donc très massivement irrigués. Chaque rein reçoit donc chaque jour 1500 L de sang et en filtre 150 à 160 L par jour. Comme le volume plasmatique est égal à
3 L, les reins filtrent donc le volume plasmatique total 50 fois par jour.

CAPET Civel Cédric Physiologie rénale Page 2 sur 17
I.2.2. Le Néphron : unité fonctionnelle
Les néphrons sont les unités structurales et fonctionnelles des reins. (Une unité fonctionnelle est le plus petit constituant d’un
organe capable d’accomplir toutes les fonctions de celui-ci). Chaque rein est constitué d’environ 1,25 millions de néphrons. Le
nombre de néphrons est fixé à la naissance et ne peut plus augmenter. Les troubles apparaissent à partir d’une perte d’environ 25%.
a) Présentation des différents segments du néphron
Chaque néphron consiste en un corpuscule de Malpighi attaché à un long tube fin, convoluté et sa vascularisation associée.
Corpuscule (rénal) de Malpighi : Il est
formé de deux composantes :
- La capsule de Bowman = sphère
invaginée appartenant au néphron, qui
enveloppe de glomérule (environ 200 µm
de diamètre).
- Le glomérule = réseau de
capillaires issus de l’artériole afférente et
qui se regroupent pour former une
artériole efférente.
Puis :
Tube contourné proximal : directement
issu de la capsule de Bowman
Anse de Henlé : L’anse de Henlé est
composé de deux branches : Une branche
descendante fine. Une branche ascendante
large
Tube contourné distal
Canal collecteur
Remarques : l’aspect strié de la zone médullaire est dû à sa composition riche en tubes collecteurs de Bellini et à l’anse de Henlé.
Il existe des néphrons courts dont le segment grêle de l’anse de Henlé est très petit (2 mm) et qui sont situés dans la zone corticale et
des néphrons longs situés dans le cortex mais dont l’anse de Henlé très longue (14 mm) plonge jusque dans la zone médullaire (rôle des
longues anses de Henlé dans l’établissement d’un gradient osmotique).

CAPET Civel Cédric Physiologie rénale Page 3 sur 17
b) L’appareil juxtaglomérulaire
À la jonction du segment ascendant de l’anse de Henlé et du tubule contourné distal, le tubule est en contact avec l’artériole
afférente et forme l’appareil juxtaglomérulaire (puisque situé près du glomérule de Malpighi).
À ce niveau, l’épithélium tubulaire va
se modifier pour former la macula densa et la
paroi de l’artériole afférente est plus épaisse
en raison de la présence des cellules
juxtaglomérulaires (ou granulaires).
L’appareil juxtaglomérulaire est donc
constitué :
- Des cellules endothéliales
juxtaglomérulaires. Ce sont des cellules
baroréceptrices, c'est-à-dire qu’elles sont
sensibles aux variations de la pression
sanguine dans l’artériole afférente. Ces
cellules sécrètent de plus une enzyme appelée
rénine dont le rôle sera vu ultérieurement.
- Des cellules de la macula densa : Ces
cellules sont osmoréceptrices (sensibles à la
pression osmotique) et chémoréceptrices du
filtrat glomérulaire (sensibles aux variations
de concentration des substances chimiques du
liquide tubulaire).
- Des cellules mésangiales associées.
Conclusion : l’appareil juxtaglomérulaire va donc jouer un rôle très important quant au rôle du rein dans la régulation de
l’équilibre hydrominéral.
c) Vascularisation du néphron
L’appareil urinaire est irrigué par l’artère rénale et le sang ressort par la veine cave inférieure.
La vascularisation est particulière car elle comprend un système porte artériel.
Système porte : c’est un système vasculaire qui fait la jonction entre 2 réseaux capillaires. Le terme artériel signifie que la
jonction entre les 2 réseaux capillaires se fait par des artérioles.
Le sang arrive dans le glomérule par une
artériole afférente qui se ramifie en formant un
groupe compact de capillaires : le glomérule de
Malpighi.
Il en ressort une artériole efférente qui irrigue
ensuite le reste du néphron en formant un réseau
de capillaires péritubulaires, lesquels sont en
contact très étroit avec les tubules rénaux. Ainsi
le sang qui irrigue les tubes urinaires est déjà
passé dans les glomérules (important). Puis les
capillaires péritubulaires débouchent dans une
veinule efférente qui rejoint la veine rénale.

CAPET Civel Cédric Physiologie rénale Page 4 sur 17
II. FONCTIONEMENT RENAL ET FORMATION DE L’URINE
II.1. Mise en évidence du fonctionnement rénal
Débit sanguin rénal : Les reins sont des organes qui représentent 0,5 % de la masse corporelle mais qui reçoivent 25 % du
débit cardiaque. Les reins sont donc très massivement irrigués.
Chaque rein reçoit donc chaque jour 1500 L de sang et en filtre 150 à 160 L par jour. Comme le volume plasmatique est égal à 3 L, les
reins filtrent donc le volume plasmatique total 50 fois par jour.
Ces chiffres, très élevés en regard de la masse et des besoins métaboliques des reins, sont en rapport avec leur rôle : filtrer le
sang, réabsorber et sécréter, ce qui permet de réguler rapidement les constituants du milieu intérieur et d’excréter de grandes quantités
de déchets.
II.1.1. Composition comparées du sang et de l’urine
Composant
Sang
Urine
(valeurs moyennes)
(mmol/L)
(mmol/L)
Na+
140-150
40-90
K+
4
40
Ca2+
1,4
14
HCO3-
25
0
Cl-
110
90
NH4+
0,005
40
Urée
6
320
Créatinine
0,1
10
Protéines
70
0
Acide urique
0,3
5
Glucose
4 à 4,5
0
On remarque que : Certaines molécules, présentes dans le plasma sont totalement absentes dans l’urine. Certaines molécules, très
diluées dans le plasma (voire absente), sont particulièrement concentrées dans l’urine.
II.1.2. Etape de la formation de l’urine
Les grandes étapes de la formation de l’urine : La première étape de la formation de l’urine est la filtration du sang au niveau
du corpuscule de Malpighi. L’eau (150 L par jour) et la plupart des constituants du plasma vont passer dans la capsule de Bowman puis
dans le tubule pour former l’urine primitive. Certaines molécules ne peuvent pas être filtrées et c’est pourquoi on ne les retrouve pas
dans l’urine (protéines).
L’urine primitive n’a pas la même composition que l’urine définitive car elle va subir deux types de modifications.
Les modifications tubulaires : Réabsorptions : La plupart des molécules filtrées vont subir des réabsorptions le long des
tubules : soit totale (glucose, acides aminés, HCO3-), soit partielle (H20 (148,5 L sur les 150 L filtrés), Na+, Cl-…). Et des Sécrétions :
La sécrétion tubulaire est le passage de substances des capillaires qui entourent le tubule dans celui-ci. Elle permet d'éliminer des
substances qui ne se trouvent pas déjà dans le filtrat comme certains médicaments, d'éliminer les substances nuisibles qui ont été
réabsorbées comme l'urée et l'ammoniac et de régler le pH sanguin. La sécrétion peut se produire tout le long du tubule. L'urine
définitive est donc le résultat d'un processus de filtration, de réabsorptions sélectives et de sécrétions.
II.2. L’ultrafiltration glomérulaire
II.2.1. Le glomérule : une surface d’échange
Le corpuscule de Malpighi présente toutes les caractéristiques d’une surface d’échange : il est très richement vascularisé : réseau
capillaire glomérulaire. Le réseau de capillaires glomérulaires à l’intérieur de la capsule de Bowman augmente considérablement la
surface d’échange entre le sang et le filtrat.
L’endothélium des capillaires glomérulaires est fenêtré et les pores ont un diamètre de 70-90nm. Les cellules de l’épithélium
(podocytes) ont de nombreux pseudopodes qui s’entrecroisent pour former des fentes de filtration le long de la paroi capillaire. Ces
fentes ont une largeur d’environ 25 nm.
La membrane glomérulaire permet le passage des substances d’un diamètre inférieur à 4 nm et interdit le passage à celle de plus
de 8 nm. Toutefois le passage est assujetti à la charge des molécules. La surface totale de l’endothélium des capillaires
glomérulaires chez l’homme est d’environ 0,8-1 m2, par rein.

CAPET Civel Cédric Physiologie rénale Page 5 sur 17
La distance entre le plasma et le filtrat est très limitée. La lame basale glomérulaire est épaisse d’environ 250 à 400 nm. De
plus, de part et d’autre de la lame basale, cette barrière présente des pores facilitant le passage des molécules :
1 : cellules épithéliales de la capsule de Bowman
2 : lumière du corpuscule de Bowman (urine primitive ou filtrat)
3 : lumière de l’artériole (sang)
5 : endothélium fenêstré
6 : lame basale
7 : podocytes
Il en résulte un filtre qui permet le passage libre des molécules. DOCUMENT
Molécules filtrées
Compositions comparées du plasma et de l’urine primaire :
Composés
Concentration dans le
plasma
Concentration dans la
capsule de Bowman
Na+ (mmol/L)
139
139
Protéines (g/L)
70
0
Glucose (mmol/L)
5
5
Urée (mmol/L)
5
5
NH4+ (mmol/L)
0,05
0,05
Acide hippurique (mmol/L)
0
0
Quantité d’eau circulant (litres/
24 heures)
720
170
Conclusion : La plupart des molécules sont totalement filtrées (glucose, urée, NH4+, acides aminés…). L’eau est partiellement
filtrée : 23 %. En fait, seules les molécules de forts poids moléculaires ne sont pas filtrées (comme les protéines). En réalité, les
molécules de poids moléculaire inférieur à 65 kDa sont filtrées. Ceci est du au filtre formé par la lame basale.
II.2.2. Mécanisme de l’ultrafiltration glomérulaire
Mécanisme relativement passif et peu sélectif. La taille du lit capillaire et la perméabilité des capillaires influencent la filtration.
La quantité de liquide qui passe dans la capsule de Bowman est gouvernée par la balance des forces hydrodynamiques :
La pression hydrostatique dans les capillaires agit en forçant le plasma hors des capillaires, mais les protéines plasmatiques ne
peuvent pas passer dans la capsule et reste dans le sang. La pression oncotique qui en résulte s’oppose à la force hydrostatique.
La somme des pressions opposées est appelée pression nette de filtration. Sa valeur influence la proportion de plasma qui va être
ultrafiltré. PNF = PHg – PHc – Po (PNF : pression nette de filtration, PHg : pression hydrostatique glomérulaire, PHc : pression
hydrostatique capsulaire ou corpusculaire, Po : pression oncotique). La quantité de plasma filtrée par unité de temps est appelé débit de
filtration glomérulaire (DFG, préférer : DUFG) et est exprimé en mL/min. PNF = 55 – 15 – 30 = 10 mm Hg.
Le débit de filtration doit être maintenu constant (environ 120 mL/min) pour que le mécanisme de filtration soit convenable.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%