Matériel et produits (pour un poste de travail)

Objectifs.
Dans un premier temps, on demande à l’élève de proposer le montage permettant d'effectuer
l’électrolyse d’une solution de sulfate de cuivre avec “anode soluble” puis de la réaliser en suivant un
protocole indiqué.
Pendant cette électrolyse, l’élève doit :
- écrire les équations des réactions aux électrodes,
- prévoir la masse de cuivre déposé à la cathode et en fin d’électrolyse vérifier sa prévision par pesée de la
cathode.
On pourra apporter des précisions sur ce mode de purification des métaux.
Dans un deuxième temps, on demande à l'élève de proposer une méthode d'électrozingage d'une plaque
de fer en s'appuyant sur les acquis de l'expérience précédente : choix des électrodes et de la solution
électrolytique, proposition du montage électrique, des réglages à opérer, des mesures à effectuer...
Comme précédemment, l’élève doit :
- écrire les équations des réactions aux électrodes,
- prévoir la masse de zinc déposé à la cathode (éventuellement l'épaisseur du dépôt métallique) et en fin
d’électrolyse vérifier sa prévision par pesée de la cathode.
On pourra apporter des précisions sur l'intérêt de ces dépôts électrolytiques.
Informations pratiques.
La qualité des dépôts obtenus est conditionnée par une préparation soigneuse de la cathode :
- polissage mécanique à la toile émeri fine,
- dégraissage à l'aide d'un détergent ou d'un solvant (acétone par exemple),
- décapage par immersion dans une solution d'acide chlorhydrique concentré (1 à 2 mol.L-1),
(Entre chaque étape, rincer à l'eau distillée et ne pas toucher la plaque avec les doigts).
La stabilité du courant pendant la durée de l'électrolyse est essentielle. Pour y parvenir :
- agiter la solution électrolytique en permanence et de façon suffisante,
- utiliser une alimentation de tension continue stabilisée (12 V- 1 A par exemple) associée à un rhéostat (une
trentaine d'ohms suffit) en série avec l'électrolyseur : ainsi, l'intensité du courant se trouvera peu affectée par les
variations possibles de la résistance interne de l'électrolyseur en cours d'expérience.
Lors de l'électrozingage, on peut recouvrir une des faces de la cathode par un adhésif pour limiter le dépôt
métallique à la face en regard avec l'anode.
Pour un recouvrement double face on pourrait utiliser une double anode en zinc.

Le réglage de la profondeur d'immersion de la cathode délimite la surface de recouvrement.
Pour réaliser l'électrozingage, l'élève est amené à demander une solution d'ions zinc (II). On lui indiquera
que la solution électrolytique utilisée renferme d'autres espèces chimiques favorisant le dépôt métallique.
Observations.
L'étude théorique de cette électrolyse est complexe.
L'analyse des potentiels normaux des couples oxydant/réducteur mis en jeu conduit à la décomposition
électrolytique de l'eau.
- A la cathode, il y aurait donc dégagement de dihydrogène ce qui fragiliserait le dépôt métallique de zinc et
entraînerait une surconsommation énergétique. Mais la surtension importante du dihydrogène sur le fer arrête
rapidement ce dégagement et permet le dépôt métallique.
Le pH de la solution électrolytique joue également un rôle dans la cinétique de décomposition de l'eau. A un pH
de 4,4 la réduction des ions zinc (II) est privilégiée.
- A l'anode , il se produit l'oxydation de l'espèce la plus facilement oxydable: c'est ici le métal Zn de l'anode dite
"soluble".
La structure de la couche métallique déposée, donc sa qualité, est influencée par plusieurs paramètres :
concentration et nature des ions, agitation du bain, température de la solution et densité de courant (en A/dm2).
Pour des densités de courant trop élevées, le transfert d'électrons est trop rapide et la diffusion des atomes n'est
pas suffisante pour obtenir une croissance des cristaux convenable.
Dans les conditions opératoires décrites, on observe :
- un noircissement de l'anode (lors des deux expériences)
- un très faible dégagement de dihydrogène à la cathode (lors de l'expérience II). Ce dégagement cesse
pratiquement dès le recouvrement de la cathode par le zinc.
Les dépôts métalliques obtenus sont bien adhérents. Les mesures ont donné :
- 30 cg de dépôt de cuivre;
- 12 cg de dépôt de zinc (soit une épaisseur d'environ 28 µm sur 6 cm2).
L'écart relatif par rapport aux résultats théoriques est lié à la précision de la balance utilisée.
La plaque de fer n'ayant pas une épaisseur constante, la mesure de l'épaisseur du dépôt n'est pas effectuée : on se
contente d'en estimer la valeur par calcul.

FICHE T.P. 10 AFFINAGE DU CUIVRE
Application aux dépôts électrolytiques
Objectifs.
Réaliser et analyser la méthode de purification du cuivre par électrolyse.
Utiliser cette technique à la réalisation d'un dépôt électrolytique d’un métal sur un autre.
Matériel et produits (pour un poste de travail)
S1 : 150 mL environ de solution de sulfate de cuivre (II) de concentration molaire 1,0 mol.L-1.
et 90 mL de solution de chlorure d'ammonium à 150 g.L-1.
Générateur de tension continue (12 V – 1 A),
Rhéostat de 33 W - 1 A,
Support isolant des plaques métalliques (à disposer au dessus d'un becher de 200 mL),
Ampèremètre (calibre 1 A),
Chronomètre,
Deux plaques de cuivre d’épaisseur voisine de 0,5 mm, larges de 1 cm et longues de 10 cm,
Une plaque de zinc et une plaque de fer (100
10
0,5 mm)
Pince métallique,
Agitateur magnétique et turbulent,
Deux becher de 200 mL,
ةprouvette graduée de 100 mL,
Soucoupe,
Balance au centigramme,
Papier absorbant,
Règle graduée,
Sèche-cheveux électrique,
Fils électriques.
La préparation préalable des plaques nécessite :

- toile émeri grain fin,
- pissette d'acétone,
- pissette d'acide chlorhydrique (à 1 mol.L-1),
- pissette d'eau distillée.
I. Quelle est la technique de l'affinage du
cuivre ?
1. Montage expérimental et protocole.
Vous disposez d'un générateur de tension continue (12 V - 1 A), d'un rhéostat (33 W - 1 A), d'un multimètre.
L'électrolyseur utilisé est constitué :
- d'un becher de 200 mL contenant la solution électrolytique,
- de deux électrodes (plaques de cuivre) soigneusement décapées et dégraissées, notées A (pour anode) et C
(pour cathode).
Ne pas toucher ces électrodes avec les doigts.
Peser les électrodes et noter leurs masses respectives au centigramme près.
Dessiner le schéma du circuit électrique à réaliser pour effectuer une électrolyse en y insérant les appareils
nécessaires pour pouvoir régler et mesurer l’intensité du courant.
Réaliser le montage. Faire vérifier par le professeur.
Verser dans le becher 150 mL environ de solution de sulfate de cuivre (II) à la concentration molaire de 1,0
mol.L-1 dans laquelle les électrodes plongent jusqu’à mi hauteur.
Installer sous le becher un agitateur magnétique en évitant que le turbulent heurte les plaques de cuivre lors de sa
rotation.
Mettre le générateur sous tension et régler rapidement l’intensité du courant à 0,50 A. Déclencher le
chronomètre. La durée de l'électrolyse est fixée à 30 minutes.
L'agitation constante de la solution est essentielle pour assurer la stabilité du courant !
Pendant la durée de cette opération, passez aux questions 2 et 3
Au bout de 30 minutes, ouvrir le circuit, extraire les deux plaques et les rincer à l’eau distillée.
Observer et décrire l'état des deux électrodes.

Sécher doucement les deux électrodes à l'aide d'un sèche-cheveux électrique. Peser à nouveau chaque électrode
et calculer la variation de leur masse respective.
Quelle constatation peut-on faire compte tenu de la précision de la balance utilisée ?
2. Comment interpréter cette électrolyse ?
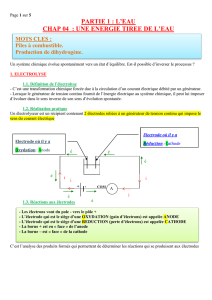
Compléter le schéma ci-contre en indiquant :
- la position de A et de C,
- le sens du courant dans le circuit électrique,
- le sens de déplacement des électrons dans les conducteurs métalliques,
- le sens de déplacement des ions cuivre(II) dans la solution électrolytique.
Identifier l'électrode à laquelle se produit la réaction d'oxydation et l'électrode à laquelle se produit la
réaction de réduction. Ecrire les réactions aux électrodes.
(Couple en jeu : Cu2+ /Cu)
En déduire la réaction d'oxydo-réduction correspondant à la transformation chimique provoquée par le
passage du courant dans le circuit.
Justifier l'expression "électrolyse à anode soluble".
Pourquoi cette technique permet-elle de purifier du cuivre contenant des traces de métaux précieux
inoxydables dans ces conditions ?
3. Peut-on prévoir la masse du dépôt de cuivre ?
Données physico-chimiques :
Charge élémentaire : q = 1,6.10 – 19 C
Constante d’Avogadro : NA = 6,02.10 23 mol – 1
Masse molaire du cuivre : MCu = 63,5 g.mol – 1
Combien faut-il d’électrons pour le dépôt d’un atome de cuivre à la cathode ?
Et pour le dépôt d’une mole d’atome de cuivre ?
Calculer la quantité d'électricité (en C) nécessaire pour le dépôt d'une mole d’atome de cuivre à la
cathode de l'électrolyseur ? qe- = NA
Calculer la quantité d’électricité (Q = I.t) qui a traversé le circuit pendant la durée de l'électrolyse.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%