Devoir Surveillé: Acide Lactique et Défibrillateur

769777120 1/4 Tle S 2008-2009
DEVOIR SURVEILLE N°5
Calculatrice interdite
EXERCICE I (18 pts) – A PROPOS DE L’ACIDE LACTIQUE …
Données pour tout l’exercice :
- pKa (CO2, H2O(aq) / HCO3-(aq)) = pKa1 = 6,1
- pKa (acide lactique / ion lactate) = pKa2 = 3,9
- produit ionique de l’eau : Ke = 10-14
- Masse molaire moléculaire de l’acide lactique : M = 90
g.mol-1
couples acide/base :
CO2, H2O(aq) / HCO3-(aq)
H2O(l) / HO-(aq)
H3O+ / H2O(l)
Aide au calcul : (toutes les données ne sont pas utiles)
102,2 = 1,6.102
101,3 = 20
109,1 = 1,3.109
log11
6
= 0,3
log a
bloga logb
10-2,2 = 6,3.10-3
10-1,3 = 5,0.10-2
10-9,1 = 7,9.10-10
log 6
11
= - 0,3
A. APPARITION D’UNE CRAMPE
Lors d’un effort physique intense et lorsque la ventilation est insuffisante, l’énergie nécessaire au fonctionnement du muscle
devient insuffisante : la crampe apparaît. Il se forme, dans la cellule musculaire, de l’acide lactique qui, lorsqu’il passe
dans le sang, provoque une diminution locale de son pH du fait de la création en abondance de dioxyde de carbone dissous
dans le sang.
Le but de cet exercice est d’expliquer, de façon très simplifiée, les processus mis en jeu lors de l’apparition d’une crampe.
1 - pH du sang et maintien de sa valeur :
Le sang est constitué d’un liquide plasmatique (contenant entre autres les globules et les plaquettes), qui peut être assimilé à
une solution aqueuse ionique dont le pH (d’une valeur voisine de 7,4) est quasiment constant et ne peut subir que de très
faibles fluctuations. Dans le cas contraire, de fortes fluctuations nuiraient gravement à la santé.
Le maintien de la valeur du pH se fait par deux processus :
- Le premier met en œuvre un ensemble d’espèces chimiques régulatrices dont notamment le couple acide-base
CO2, H2O(aq) / HCO3-(aq) (couple dioxyde de carbone dissous / ion hydrogénocarbonate) grâce à l’équilibre :
CO2, H2O(aq) + H2O(l) = HCO3–(aq) + H3O+(aq) (réaction 1).
- Le deuxième processus physico-chimique est la respiration.
A une température de 37°C le pH d’un sang artériel « normal » est de 7,4.
Données à 37°C :
Pour le sang avant l’effort : [HCO3-]i = 2,7
10-2 mol.L-1 [CO2, H2O]i = 1,4
10-3 mol.L-1
1. 1. Donner l’expression de la constante d’acidité Ka1 associée au couple régulateur (réaction 1).
En déduire la relation entre le pH et le pKa1 du couple CO2, H2O / HCO3–.
1. 2. Calculer alors la valeur du rapport
[HCO 3
]éq
[CO2,H2O]éq
dans le sang artériel normal.
1. 3. Lors d’un effort physique, la concentration en dioxyde de carbone dissous dans le sang, au voisinage du muscle,
augmente. Comment devrait varier le pH du sang ?
2. L’acide lactique
L’acide lactique a pour formule CH3–CHOH–COOH. Sa base conjuguée est l’ion lactate CH3–CHOH–COO–.
2.1. Donner la définition d’un acide (selon Brönsted).
2.2. Ecrire l’équation de la réaction de l’acide lactique avec l’eau.
2.3. Dans la cellule musculaire, l’acide lactique est formé à partir de l’acide pyruvique de formule CH3–CO–COOH. La
transformation produite est une oxydoréduction faisant intervenir le couple acide pyruvique / acide lactique.

769777120 2/4 Tle S 2008-2009
Écrire la demi-équation électronique associée au couple. S’agit-il d’une oxydation ou d’une réduction de l’acide pyruvique
dans la cellule musculaire ?
3. Variation locale du pH sanguin en l’absence des processus de maintien :
Lorsque l’acide lactique produit dans la cellule musculaire est en partie transféré dans le sang, il réagit avec les ions
hydrogénocarbonate selon l’équation :
CH3–CHOH–COOH(aq) + HCO3–(aq) = CH3–CHOH–COO–(aq) + CO2,H2O(aq) (réaction 3)
On considère un volume V = 100 mL de sang « après » effort dans lequel apparaît n0 = 3,010–4 mol d’acide lactique.
On pourra noter AH(aq) / A-(aq) le couple acide lactique / ion lactate par commodité d’écriture.
3.1. Calculer la constante d’équilibre K de la réaction 3.
3.2. En calculant Qr,ini pour cette réaction, justifier qu’elle a bien lieu dans le sens direct.
3.3. Compléter un tableau d’évolution du système et montrer que K et xéq sont reliés par la relation :
K = xéq(A xéq)
(B xéq)(C xéq)
où A, B et C sont des constantes que l’on déterminera.
3.4. Connaissant K, on accède par résolution mathématique à deux valeurs possibles pour xéq : xéq1 = 2,7.10-3 mol ou xéq2 =
3,0.10-4 mol. Quelle est la seule valeur acceptable ? Pourquoi ?
3.5. Calculer alors le taux d’avancement final et conclure.
3.6. Calculer alors pour le sang après effort : [HCO3–]éq et[CO2, H2O]éq. En déduire le pH local du sang après effort.
Conclure.
B. DOSAGE DE L’ACIDE LACTIQUE DU LAIT
On dose l’acide lactique, noté HA(aq) comme précédemment et considéré comme seul acide présent dans le lait étudié, par
une solution aqueuse d’hydroxyde de sodium, Na+(aq) + HO-(aq), de concentration cB = 5,00.10-2 mol.L-1.
On prélève un volume VA = 20,0 mL de lait que l’on place dans un bécher et on suit l’évolution du pH en fonction du
volume VB de soude versé.
1.1 Ecrire l’équation de la réaction qui se produit lors du mélange.
1.2 Quelles caractéristiques doit présenter cette réaction pour être adaptée à un dosage ?
1.3 Exprimer puis calculer la constante d’équilibre K associée à cette réaction. Confirmer alors partiellement la réponse
donnée à la question 1.2
2. Au cours du dosage, on obtient le tableau de valeurs suivant :
VB (mL)
0
2,0
4,0
6,0
8,0
10
11
11,5
12
12,5
13
14
16
pH
2,9
3,2
3,6
3,9
4,2
4,6
4,9
6,3
8,0
10,7
11,0
11,3
11,5
2.1 En utilisant un diagramme de prédominance, déterminer quelle est, entre HA(aq) et A-(aq), l’espèce chimique
prédominante au début du dosage.
2.2 Pour quel volume de soude versé, HA(aq) et A-(aq) sont-elles présentes en quantités égales ? Justifier.
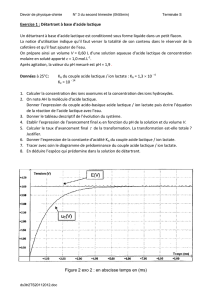
2.3 Tracer le graphe pH = f(VB). Déterminer précisément par une méthode graphique les coordonnées (pHE et VBE) du point
d’équivalence.
2.4 Parmi les indicateurs colorés suivants, lequel aurait été le plus adapté pour réaliser le dosage ? Justifier.
2.5 Déterminer en justifiant la concentration d’acide lactique dans le lait.
2.6 On considère qu’un lait est frais si sa concentration en acide lactique
est inférieure à 1,8 g.L-1. Qu’en est-il du lait dosé ici ? Justifier.
EXERCICE II (18 pts) - DÉFIBRILLATEUR CARDIAQUE
Indicateur coloré
Zone de virage
Rouge de méthyle
4,2 – 6,2
Bleu de bromophénol
3,0 – 4,6
Rouge de crésol
7,2 – 8,8

769777120 3/4 Tle S 2008-2009
Le défibrillateur cardiaque est un appareil utilisé en médecine d'urgence. Il permet d'appliquer un choc électrique sur le
thorax d'un patient, dont les fibres musculaires du cœur se contractent de façon désordonnée (fibrillation). Le défibrillateur
cardiaque peut être représenté de façon simplifiée par le schéma suivant :
Le générateur délivre une tension constante E =
1,5 kV.
La capacité du condensateur C est de 470 µF .
Le thorax du patient sera assimilé à un
conducteur ohmique de résistance R = 50
.
Aide au calcul :
1,52 = 2,3
235 2,3 = 5,3.102
235 5,5 = 1,3.103
7,42 = 5,5.101
1,5 6,3 = 9,5
2,3
235 9,8.103
5,5
235 2,2.102
1. Phase A
Lors de la mise en fonction du défibrillateur, le manipulateur obtient la charge du condensateur C (initialement déchargé)
en fermant l'interrupteur K1 (K2 étant ouvert).
1.1. Quel est, parmi les documents présentés ci-dessous, celui qui correspond à cette phase du processus ? Justifier.
1.2. En utilisant ce même document, déterminer par la méthode de votre choix, la constante de temps du circuit lors de
cette même phase.
1.3. Montrer que la valeur maximale Emax de l'énergie que peut stocker le condensateur C est de l’ordre de 500 J environ.
1.4. Au bout de quelle durée t le
condensateur peut-il être considéré comme
chargé ?
2. Phase B
Thorax du patient
Générateur
de tension
1,5 kV
uC
K1
1
K2
Électrodes
i(t)
C

769777120 4/4 Tle S 2008-2009
Dès que le condensateur C est chargé le manipulateur peut envoyer le choc électrique en connectant le condensateur aux
électrodes posées sur le thorax du patient. Il choisit alors le niveau d'énergie du choc électrique qui sera administré au
patient, par exemple Edélivrée = 400 J .
À la date initiale t0 le manipulateur ferme l’interrupteur K2 (K1 ouvert) ce qui provoque la décharge partielle du
condensateur ; la décharge est automatiquement arrêtée dès que l'énergie choisie a été délivrée.
2.1. En assimilant le thorax du patient à un conducteur ohmique de valeur R = 50 , déterminer l’équation différentielle
vérifiée par uC lors de cette phase. (On respectera les conventions imposées par le schéma )
2.2 La solution de cette équation est de la forme :
uC(t) Ae
t
. Déterminer les expressions littérales de A et de . Préciser
les unités.
2.3 En déduire l’expression de i(t), en fonction de E, R et C. Commenter le signe de cette expression.
2.4 Tracer l’allure de la courbe représentant les variations de i en fonction du temps. À quelle date l'intensité du courant est-
elle maximale en valeur absolue ? Calculer cette valeur. Dépend-elle de la capacité du condensateur ? Justifier.
3. Phase C
La décharge s'arrête dès que l'énergie électrique Ed de 400 J, initialement choisie, a été délivrée.
3.1. Déterminer graphiquement, en utilisant l'un des documents ci-dessus, la date t1 à laquelle la décharge partielle du
condensateur est arrêtée. Vérifier alors graphiquement que la valeur de la tension uC(t1 ) est de 740 V environ.
3.2. Quelle est alors à la date t1 la valeur de l’énergie encore disponible dans le condensateur ? En considérant que l’énergie
maximale Emax accumulée dans la phase A vaut 5,3.102 J, montrer que l’énergie délivrée à la date t1 a bien la valeur
souhaitée.
1
/
4
100%