SNC 1DF Est-ce qu`un changement chimique change la masse

SNC 1DF Est-ce qu’un changement chimique change la masse ?
Objectif
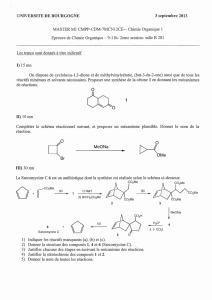
Pour cette activité, vous allez observe 3 réactions chimiques pour déterminer la masse totale des produits formés lors d’une
réaction chimique est égale a la masse totale des réactifs.
Matériaux
Substances chimiques: 1. les solutions de _____________________________________________
2. les solutions de _____________________________________________
3. les solutions de _____________________________________________
Équipement: flasque Erlenmeyer, bouchon de caoutchouc, Éprouvette petite, balance électronique
Procédé
1. Faites les réactions un à la fois. Pour chaque paire de solutions, versez à peu près 10mL de solution dans la flasque.
Remplissez a la moitié une petite éprouvette avec l’autre solution. Décrivez les réactifs en utilisant le tableau des observations
qualitatives.
2. Soigneusement, pour que les deux solutions ne mélangent pas, glissez l’éprouvette dans la flasque.
3. Mettez le bouchon fermement dans la flasque. Utilisez la balance pour trouver la masse totale de la flasque close et ses
contenants. Écrivez cette masse initiale dans votre tableau d’observations quantitative.
4. Enlevez la flasque de la balance. Inclinez la flasque pour mélange les deux solutions. Soyez prudent pour ne pas briser
l’éprouvette. Écrivez vos observations dans le tableau d’observations qualitatives.
5. Remettre la flasque sur la balance et mesurez la masse. Écrivez cette masse (la masse des produits et la flasque close) dans ton
tableau d’observations quantitatives.
6. Jetez les contenants de la flasque dans le “slush bucket” comme diriger par ta enseignante. Nettoyez la flasque et l’éprouvette
prudemment. Répétez le procédé pour les deux autres paires de solutions.
SNC 1DF Est-ce qu’un changement chimique change la masse ?
Objectif
Pour cette activité, vous allez observe 3 réactions chimiques pour déterminer la masse totale des produits formés lors d’une
réaction chimique est égale a la masse totale des réactifs.
Matériaux
Substances chimiques: 1. les solutions de _____________________________________________
2. les solutions de _____________________________________________
3. les solutions de _____________________________________________
Équipement: flasque Erlenmeyer, bouchon de caoutchouc, Éprouvette petite, balance électronique
Procédé
1. Faites les réactions un à la fois. Pour chaque paire de solutions, versez à peu près 10mL de solution dans la flasque.
Remplissez a la moitié une petite éprouvette avec l’autre solution. Décrivez les réactifs en utilisant le tableau des observations
qualitatives.
2. Soigneusement, pour que les deux solutions ne mélangent pas, glissez l’éprouvette dans la flasque.
3. Mettez le bouchon fermement dans la flasque. Utilisez la balance pour trouver la masse totale de la flasque close et ses
contenants. Écrivez cette masse initiale dans votre tableau d’observations quantitative.
4. Enlevez la flasque de la balance. Inclinez la flasque pour mélange les deux solutions. Soyez prudent pour ne pas briser
l’éprouvette. Écrivez vos observations dans le tableau d’observations qualitatives.
5. Remettre la flasque sur la balance et mesurez la masse. Écrivez cette masse (la masse des produits et la flasque close) dans ton
tableau d’observations quantitatives.
6. Jetez les contenants de la flasque dans le “slush bucket” comme diriger par ta enseignante. Nettoyez la flasque et l’éprouvette
prudemment. Répétez le procédé pour les deux autres paires de solutions.

Observations :
En utilisant un autre feuille de papier, dessinez les tableaux avec les titres donnés ci-dessous :
Tableau d’observations qualitatives
Noms des réactifs
Description des réactifs
description de la réaction et des
produits
Tableau d’observations quantitatives
Réaction #
(noms des réactifs)
Masse des réactifs (g)
Masse des produits (g)
Discussion
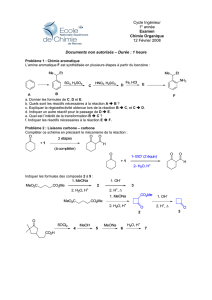
1. Pour chaque réaction, expliquez comment vous savez qu’un changement chimique a eu lieu.
2. La Loi de conservation de la matière stipule que la masse totale des produits formés lors d’une réaction chimique
est égale a la masse totale des réactifs. Les résultats obtenus dans la classe appuient-ils cet énonce ? Justifiez.
3. Votre professeur identifiera tous les produits formés; écrivez l’équation nominative de chacune des réactions chimiques.
4. Étudiez-en l’équation nominative : Cire(s) + Oxygène (g) Gaz carbonique (g) + eau (g)
Lorsqu’une bougie brûle, elle raccourcit. Sa masse diminue. Pourquoi la masse du solide diminue-t-elle ?
5. 20 g de soufre réagissent à 30 g d’oxygène. Quelle sera la masse du produit, le trioxyde de soufre (SO3(s)) Écrivez
l’équation nominative de la réaction.
Observations :
En utilisant un autre feuille de papier, dessinez les tableaux avec les titres donnés ci-dessous :
Tableau d’observations qualitatives
Noms des réactifs
Description des réactifs
description de la réaction et des
produits
Tableau d’observations quantitatives
Réaction #
(noms des réactifs)
Masse des réactifs (g)
Masse des produits (g)
Discussion
1. Pour chaque réaction, expliquez comment vous savez qu’un changement chimique a eu lieu.
2. La Loi de conservation de la matière stipule que la masse totale des produits formés lors d’une réaction chimique
est égale a la masse totale des réactifs. Les résultats obtenus dans la classe appuient-ils cet énonce ? Justifiez.
3. Votre professeur identifiera tous les produits formés; écrivez l’équation nominative de chacune des réactions chimiques.
4. Étudiez-en l’équation nominative : Cire(s) + Oxygène (g) Gaz carbonique (g) + eau (g)
Lorsqu’une bougie brûle, elle raccourcit. Sa masse diminue. Pourquoi la masse du solide diminue-t-elle ?
5. 20 g de soufre réagissent à 30 g d’oxygène. Quelle sera la masse du produit, le trioxyde de soufre (SO3(s)) Écrivez
l’équation nominative de la réaction.
1
/
2
100%