Word

1
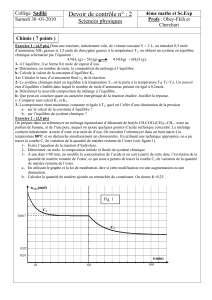
Rapport de laboratoire
CHI 1512
Expérience 6
Synthèse de composés du cuivre
Nom : …………………………………..
Nom : …………………………………..
But:
Effectuer la transformation de l'élément cuivre en divers produits, par synthèses
successives.
Objectifs de l'expérience:
Maîtriser plusieurs techniques analytiques.
a) Solubiliser un métal à l'aide d'un acide fort.
b) Précipiter un ion métallique sous forme d'hydroxyde.
c) Réduire une solution ionique afin d'obtenir le métal correspondant.
Réactions
a) Dissolution du cuivre avec l'acide nitrique
Observations : _________________________________________________________________
_____________________________________________________________________________

2
Équation complète
Cu + 4HNO3 -----> Cu(NO3)2 + 2NO2 + 2H2O
Équation ionique
______________________________________________________________________________
1 mole de Cu soit ______ g donnera 1 mole de Cu(NO3)2 soit ______ g
_______ g de Cu pesé donneront _______ g soit ________ mole de Cu(NO3)2
b) Précipitation de l'hydroxyde de cuivre
Observations : _________________________________________________________________
_____________________________________________________________________________
Équation complète
Cu(NO3)2 + 2NaOH ------> Cu(OH)2 (s) + 2NaNO3
Couleur ________ _______ ___________ _________
Équation ionique
______________________________________________________________________________
1 mole de Cu(NO3)2 soit ______ g donnera 1 mole de Cu(OH)2 soit ______ g
______ g de Cu(NO3)2 donnera _______ g soit ________ mole de Cu(OH)2
c) Formation de l'oxyde de cuivre
Observations : _________________________________________________________________
_____________________________________________________________________________
Équation complète
Cu(OH)2 -----> CuO + 2H2O

3
Équation ionique
______________________________________________________________________________
1 mole de Cu(OH)2 soit ______ g donnera 1 mole de CuO soit ______ g
_______ g de Cu(OH)2 donneront _______ g soit ________ mole de CuO.
d) Dissolution de l'oxyde de cuivre par l'acide sulfurique
Observations : _________________________________________________________________
_____________________________________________________________________________
Équation complète
CuO + H2SO4 -----> CuSO4 + H2O
Équation ionique
______________________________________________________________________________
1 mole de CuO soit ______ g donnera 1 mole de CuSO4 soit ______ g
_______ g de CuO donneront _______ g soit ________ mole de CuSO4.
e) Réduction de Cu(II) par Zn
Observations : _________________________________________________________________
_____________________________________________________________________________
Équation complète
Cu SO4 + Zn -----> Cu + ZnSO4
Équation ionique
______________________________________________________________________________
1 mole de CuSO4 soit ______ g donnera 1 mole de Cu soit ______ g
_______ g de CuSO4 donneront _______ g soit ________ mole de Cu.

4
f) Élimination de l'excédent de Zn
Observations : _________________________________________________________________
_____________________________________________________________________________
Équation complète
Zn + 2HCl-----> ZnCl2 + H2
Équation ionique
______________________________________________________________________________
1 mole de CuSO4 soit ______ g demande 1 mole de Zn soit ______ g
_______ g de CuSO4 ont demandé _______ g soit ________ mole de Zn.
______ g de Zn soit _______ mole ont été pesés soit un excédent de _______g soit ______ mole.
Cet excédent de Zn produira _______ mole de H2 soit _______ g ou _______ L si l'on suppose
une pression de 1 atm et un température de 300o K.

5
Discussions
A- Comparer le poids de cuivre obtenu avec celui prévu. Quelles sont les causes d'erreurs les plus
probables qui pourraient soit augmenter soit diminuer le poids de cuivre obtenu ?
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
B- Ce cycle de réactions permettant de retrouver l'élément de départ en obtenant des produits de
différentes couleurs n'est possible qu'avec peu d'éléments du tableu périodique. Identifier pour
chacune de étapes la condition qui permet que cette étape se produise
a) Il faut que le cuivre soit attaqué par l'acide nitrique.
b) __________________________________________________________________________
______________________________________________________________________________
c) __________________________________________________________________________
______________________________________________________________________________
d) __________________________________________________________________________
______________________________________________________________________________
e) __________________________________________________________________________
______________________________________________________________________________
f) __________________________________________________________________________
______________________________________________________________________________
D'après les données fournies ( solubilité, couleur, potentiel d'oxydo-réduction ) dans le Handbook
of Chemistry and Physics, votre livre de chimie minérale ou d'autres sources, proposer une série
de transformation ( si possible un cycle) pour un autre élément du tableau périodique. Indiquer
les réactions et les observation (précipitation, mise en solution, couleur) prévues.
1
/
5
100%