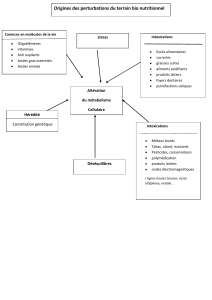
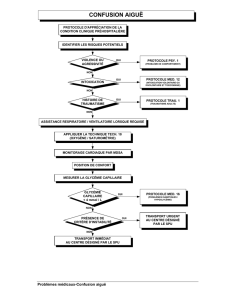
Les modalités d`assistance circulatoire en 2005

1
TABLE DES MATIERES
Physiopathologie et biomarqueurs dans l’insuffisance cardiaque
........................................................................................................... 1
Le traitement médical de l’insuffisant cardiaque en 2005 ............. 4
Indications et modalités de l'assistance circulatoire en 2005,
acharnement thérapeutique ou bien perspective qui nous
concerne tous! .................................................................................. 8
Intoxications graves par les cardiotropes .................................... 10
Monitoring per-opératoire de l’insuffisant cardiaque .................. 28
ANESTHESIE DU CORONARIEN EN CHIRURGIE NON
CARDIAQUE : STRATEGIE DE PREVENTION DES INFARCTUS
DU MYOCARDE PERIOPERATOIRES. .......................................... 30
Optimisation hémodynamique peropératoire. Quels objectifs
thérapeutiques? .............................................................................. 38
-----------------------------------------------------------------------------------------------------------------
-----------------------------------------------------------------------------------------------------------------
PHYSIOPATHOLOGIE ET BIOMARQUEURS DANS
L’INSUFFISANCE CARDIAQUE
Docteur Fabrice BAUER, CHU ROUEN
L’insuffisance cardiaque se caractérise par des anomalies structurelles du myocarde
et/ou de la fonction conduisant aux symptômes habituels : dyspnée, fatigue. La
physiopathologie de l’insuffisance cardiaque est complexe ; les différents
mécanismes délétères sont intriqués. Toutefois, il existe un dénominateur commun
qui est le remodelage ventriculaire gauche dans lequel la taille, la configuration et la
fonction du myocarde sont profondément perturbées. L’insuffisance cardiaque
débute toujours par un mécanisme initiateur.
Physiopathologie de l’insuffisance cardiaque
Le mécanisme initiateur : Le mécanisme initiateur est soit génétique ou acquis,
chronique ou aigu, par surcharge en pression ou destruction myocytaire. Selon la
vitesse de constitution de l’insuffisance cardiaque, le patient peut rester
asymptomatique pendant longtemps. C’est malheureusement à ce stade infraclinique
qu’il serait souhaitable d’agir sur le remodelage ventriculaire gauche même si les

2
preuves d’une quelconque efficacité thérapeutique sont peu rapportées dans la
littérature.
Réponse à l’agression myocardique : le remodelage ventriculaire : La réparation
d’un tissu organique est un phénomène universel afin d’assurer la survie de
l’individu. Au niveau cardiaque, les mécanismes adaptifs sont 1) fonctionnels ou
hémodynamiques avec la conservation d’un débit et d’une pression artérielle
compatible avec la vie et 2) tissulaires, peu différents des autres organes, marqués
par l’inflammation, le dépôt de collagène et l’hypertrophie des cellules viables
adjacentes. Malheureusement, les cardiomyocytes, cellules hautement différenciées,
sont incapables de se diviser. Il est à noter que l’apoptose est un phénomène
fréquent au sein du myocarde qui majore la perte des unités contractiles « saines »
et aggrave la dysfonction cardiaque.
Sur le plan phénotypique, on distingue 2 types de réponse. La première, de type
dilatation ventriculaire, caractérise les surcharges en volume (insuffisance aortique et
insuffisance mitrale) et la cardiopathie ischémique. La seconde, de type hypertrophie
myocardique, est la particularité des surcharges en pression (rétrécissement aortique
et hypertension artérielle). C’est une étape de transition avant la dilatation
ventriculaire. Les mécanismes de ces expressions phénotypiques sont actuellement
mal connus même si l’activation du programme génétique est probable.
Pérennisation de l’agression myocardique :
Le remodelage, qui se veut un phénomène de réparation et d’adaptation à
l’agression myocardique, va rapidement dépasser son but et aggraver l’insuffisance
cardiaque. Ces facteurs qui pérennisent l’agression myocardique sont principalement
hormonaux : le système rénine-angiotensine-aldostérone et le système nerveux
sympathique. D’autres facteurs sont impliqués tels que la down régulation du
sarcolème (protéine de stockage du calcium) et des récepteurs adrénergiques,
l’activation d’un programme fœtal, des modifications structurelles des protéines
contractiles ou encore la surexpression d’hormones régulatrices telles que la BNP,
l’angiotensine II tissulaire. Cependant, il est impossible à dire si cette constellation de
réponse est la cause ou la conséquence de la pérennisation de l’agression
myocardique.
Effets délétères de la noradrénaline, de l’angiotensine II et l’aldostérone: Les
effets délétères de ces molécules sont très variés et relativement communs. Les taux
de noradrénaline sont habituellement élevés chez les patients insuffisants cardiaques
et sont proportionnels à la sévérité de la maladie. Les effets bénéfiques mais aussi
délétères de la noradrénaline sont connus depuis longtemps : inotrope positif et
augmentation de la consommation du myocarde en oxygène, vasoconstriction,
redistribution sanguine du territoire splanchnique vers le cœur et le muscle
squelettique, rétention hydrosodée indirectement par la vasoconstriction rénale,
activation du système rénine-angiotensine-aldostérone et effet pro arythmique. A
l’échelle tissulaire la noradrénaline est responsable de l’expression des gènes
foetaux, de l’hypertrophie, de l’apoptose et de la nécrose myocytaire. Toutes ces
fonctions contribuent à l’aggravation de l’insuffisance cardiaque.
La fibrose myocardique : La fibrose myocardique est l’un des acteurs principaux de la
morbimortalité liée à l’insuffisance cardiaque. Qu’elle soit systématisée ou diffuse
comme dans la myocardiopathie primitive, la fibrose est à l’origine des troubles du
rythme ventriculaire grandement favorisés par une anomalie des flux calciques et
l’hypokaliémie secondaire à l’utilisation de diurétiques. Par ailleurs, la fibrose est à

3
l’origine d’une rigidité ventriculaire responsable d’une restriction myocardique source
d’œdème pulmonaire et de surmortalité. Enfin la fibrose participe à la genèse des
troubles conductifs intra ventriculaires par disjonction cellulaire qui se traduit par la
survenue d’un bloc de branche gauche et d’un asynchronisme de contraction le plus
souvent de la paroi postéro-latérale. C’est le mécanisme physiopathologique à
l’origine du concept de la resynchronisation bi ventriculaire.
Biomarqueurs de l’insuffisance cardiaque
Les marqueurs de l’insuffisance cardiaque peuvent être divisés en médiateurs neuro-
hormonaux, en marqueurs de l’agression myocytaire et du remodelage et les
indicateurs de la réponse inflammatoire.
Médiateurs neuro-hormonaux:
Il existe 3 peptides natriurétiques majeurs partageant une structure commune de 17
aminoacides: le peptide atrial natriurétique (ANP), le peptide natriurétique de type C
d'origine endothéliale et le Brain Natriuretic Peptide (BNP) d'origine cardiaque le plus
largement utilisé. La libération de ces peptides à partir des granules de stockage
résulte de l'étirement des cardiomyocytes secondaires à une élévation du stress
pariétal par surcharge en pression ou volume. Le BNP est libéré par les
cardiomyocytes ventriculaires après clivage du pro-BNP en NT-proBNP et BNP.
Tous deux sont plus spécifiques de la dysfonction ventriculaire. Ils ont un intérêt
diagnostic dans la dyspnée d’origine cardiaque et de l'insuffisance cardiaque
diastolique, permettent de stratifier la sévérité de l'insuffisance cardiaque. Par
ailleurs, la décroissance du BNP témoigne de l’efficacité thérapeutique et est
corrélée au pronostic de l’insuffisance cardiaque. 1, 2
L’insuffisance cardiaque se caractérise également par une activation de 2 systèmes
vasoconstricteurs : le système rénine-angiotensine-aldostérone et le système
adrénergique. L’élévation de l’activité rénine plasmatique, l’augmentation de la
concentration en angiotensine II ou encore des catécholamines circulantes ont été
démontrées dans les grandes études thérapeutiques de morbimortalité sur les IEC
ou les béta-bloquants. Cette surexpression est directement corrélée à la sévérité et
le pronostic de l’insuffisance cardiaque. Toutefois l’intérêt de leur dosage en clinique
est relativement limité. 3
Marqueurs de l’agression myocytaire : La troponine est le chef de fil des
marqueurs de l’agression myocytaire quelque soit le mécanisme coronarien ou non. 4
La troponine n’est pas spécifique de l’infarctus du myocarde. A un stade avancé de
l’insuffisance cardiaque, et lors des épisodes de décompensation, l’élévation de la
troponine est fréquente indépendamment de tout mécanisme ischémique. Cette
élévation est directement corrélée au statut hémodynamique et au pronostic de la
maladie mais également à sa rapidité d’évolution.
Les autres marqueurs de l’agression myocytaires sont la protéine de liaison aux
acides gras cardiaques (heart-type fatty acid binding protein) et la chaîne légère de
type 1 de la myosine (myosin light chain-1). 5 Leur rôle dans l’insuffisance cardiaque
reste à ce jour marginal. Certaines études ont démontré l'intérêt potentiel du dosage
de ces molécules dans la stratification de l’insuffisance cardiaque en combinaison au
BNP.
Enfin, la tendance actuelle est aux biomarqueurs du remodelage de la matrice
extracellulaire. Le polymorphisme du gène de la métalloprotéinase dépend du

4
phénotype et de l’étiologie de l’insuffisance cardiaque. Les bénéfices de la
spironolactone dans l’étude RALES pourraient s’expliquer par limitation du turnover
de la matrice.
Les indicateurs de la réponse inflammatoire
Les marqueurs inflammatoires de l’insuffisance cardiaque sont très nombreux. Ils
sont particulièrement pertinents chez les sujets âgés où ils sont prédictifs d’un
premier évènement de type insuffisance cardiaque. Ces marqueurs n’ont aucune
spécificité et sont retrouvés dans de nombreuses autres pathologies. Les plus
fréquemment rapportés dans la littérature sont les récepteurs de l’IL-1, de l’IL-2, l’IL
18 et autres cytokines. 6 Sur un plan clinique, la CRP est élevée dans l’insuffisance
cardiaque ; l’élévation est plus éloquente lors des exacerbations.
REFERENCES:
1. McDonagh TA. Biochemical detection of left ventricular systolic dysfunction.
Lancet 1998; 351: 9-13.
2. Gardner RS. N-terminal pro-brain Natriuretic peptide: a new gold standard in
predicting mortality in patients with advanced heart failure
3. Givertz MM, Braunwald E. Neurohormones in heart failure : predicting outcomes,
optimizing care. Eur Heart J 2004; 25: 281-282.
4. Horwich TB. Cardiac troponin I is associated with impaired hemodynamics,
progressive left ventricular dysfunction, and increased mortality rates in patients
with chronic heart failure. Circulation 2003; 108: 833-838.
5. Arimoto T. Pronostic value of elevated circulating heart-type fatty acid binding
protein in patients with congestive heart failure. J Card Fail 2005; 11: 56-60.
6. Limas CJ. Prognostic significance of soluble interleukin-2 receptor levels in
patients with dilated cardiomyopathy. Eur J Clin Invest 2003; 33: 443-448.
-----------------------------------------------------------------------------------------------------------------
-----------------------------------------------------------------------------------------------------------------
LE TRAITEMENT MEDICAL DE L’INSUFFISANT
CARDIAQUE EN 2005
Yves Juillière. Cardiologie, CHU Nancy-Brabois, 54500 Vandoeuvre-les-Nancy
L’insuffisance cardiaque est une des pathologies cardiovasculaires la plus
« cadenassée » par des recommandations thérapeutiques précises étayées par de
nombreux essais cliniques.
I- Ce qu’on doit faire impérativement
Le traitement repose sur l’association reine IEC-bêtabloquant en plus d’un diurétique.
A - Inhibiteurs de l’enzyme de conversion (IEC)

5
Les IEC sont devenus incontournables et leur efficacité sur la réduction de morbi-
mortalité a été confirmée dans toutes les classes de l’insuffisance cardiaque, que les
patients soient symptômatiques ou non et quelle que soit l’étiologie. Les posologies
utilisées doivent toujours être maximales (ou plutôt optimales, c’est-à-dire les plus
élevées possibles selon la tolérance des patients). L’attitude pratique consiste à
augmenter progressivement la posologie en contrôlant la fonction rénale 4 à 7 jours
après l’initiation ou chaque augmentation posologique. Leur prescription doit être
privilégiée et pour cela, la posologie diurétique ou d’autres vasodilatateurs sera
éventuellement réduite.
En cas de dysfonction ventriculaire gauche asymptomatique, les IEC sont la seule
thérapeutique recommandée et doivent également être prescrits à posologie
optimale.
B - Bêtabloquants
Les bêtabloquants sont la seconde thérapeutique incontournable et doivent être
associés systématiquement avec les IEC. Leur efficacité en matière de réduction de
morbi-mortalité a été démontrée dans les classes II et III mais aussi dans
l’insuffisance cardiaque sévère de classe IV stable (ils ne peuvent pas être introduits
tant que des signes de surcharge hydrique persistent). Ils doivent être prescrits chez
des patients encore symptomatiques malgré l’IEC à dose optimale. La posologie sera
également optimale. Elle est débutée à faible dose puis doublée par palier toutes les
2 semaines. L’étude SENIORS a confirmé l’intérêt de cette classe chez les sujets
âgés.
Chez les patients asymptomatiques, les bêtabloquants n’ont démontré d’intérêt que
dans la dysfonction ventriculaire post-infarctus et doivent donc être réservés aux
patients coronariens.
Pour l’instant, il n’a jamais été démontré qu’il puisse y avoir une efficacité identique
lorsque le bêtabloquant est prescrit chez un patient ne recevant pas d’IEC.
C - Diurétiques
Les diurétiques sont incontournables chez les patients symptomatiques afin de
réduire la surcharge hydrique. Ils améliorent les symptômes cliniques, la tolérance à
l’effort et la qualité de vie. Toutefois, du fait de la stimulation neuro-hormonale
délétère induite à long terme, leur posologie doit être progressivement réduite à la
posologie minimale permettant de maintenir la stabilité hémodynamique chez des
patients recevant un IEC et un bêtabloquant. Il faudra éventuellement moduler cette
posologie afin de privilégier l’association IEC-bêtabloquant si des problèmes de
tolérance tensionnelle ou rénale existent.
Toutes les classes de diurétiques peuvent être utilisées. Un problème
d’accoutumance aux diurétiques de l’anse peut s’instaurer et l’association avec un
diurétique thiazidique peut alors être bénéfique car synergique. Il sera alors impératif
d’envisager une surveillance biologique rénale étroite.
II - Ce qu’on peut discuter selon les cas
A - Anti-aldostérones
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%