Cours de chimie 2nde * chapitre II

1S - cours de chimie :
Chapitre VI
AVANCEMENT D’UNE REACTION CHIMIQUE
I-. Stœchiométrie
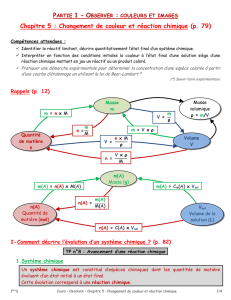
La réaction étudiée en TP a pour équation : I2(aq) + 2 S2O32-(aq) 2 I-(aq) + S4O62-(aq)
L’équation montre qu’une mole de molécules de I2 réagit avec deux moles de d’ions S2O32- pour donner deux moles d’ions
I- et une mole d’ions S4O62-. Les nombres 1, 2, 2 et 1 sont les nombres stoechiométriques.
Plus généralement, 1x mol de I2 réagit avec 2x mol d’ions S2O32- pour former 2x mol d’ions I- et 1x mol d’ions S4O62-.
Lors d’une réaction chimique, les quantités de matière des réactifs consommés et les quantités de matière des produits
formés dépendent les unes des autres. On appelle stœchiométrie les relations de proportionnalité qui existent entre ces
quantités de matière.
II- Avancement
L’avancement d’une réaction, noté x, est une grandeur, exprimée en mole qui permet de décrire l’évolution d’un système
chimique (mélange d’espèces chimiques) au cours d'une réaction chimique.
Pour la réaction entre I2 et S2O32-, l’avancement est égal à la quantité de I2 consommée ou à la quantité de S4O62- produite.
D’une manière général, l’avancement est toujours égale à la quantité de réactif consommé ou de produit formé dont le
coefficient stœchiométrique est égal à 1.
Initialement, avant de mélanger les réactifs et que la réaction ne débute, l’avancement est nul, x = 0 mol.
Au cours de la réaction, la valeur de l’avancement x augmente.
A la fin de la réaction, lorsqu’au moins un des réactifs est entièrement consommé, l’avancement atteint sa valeur
maximale, notée xmax.
III-. Evolution du système
Le tableau d’avancement décrit l’évolution des quantités de matière d’un système de l’état initial à l’état final, en
fonction de l’avancement x.
Les nombres placés devant l’avancement x sont égaux aux nombres stœchiométriques de l’équation.
Ils sont précédés d’un signe « - » pour les réactifs et d’un signe « + » pour les produits.
équation chimique
I2(aq) + 2 S2O32-(aq) 2 I-(aq) + S4O62-(aq)
état du système
avancement
(mol)
quantités de matière présentes dans le système (mol)
état initial
x = 0
n ( I2(aq) )i
n (S2O32-(aq))i
0
0
état intermédiaire
x
n ( I2(aq) )i - x
n (S2O32-(aq))i - 2x
2 x
x
état final
xmax
n ( I2(aq) )i – xmax
n (S2O32-(aq))i - 2xmax
2 xmax
xmax
IV- Réactif limitant et avancement maximal
1. Définition
Le réactif qui s’épuise en premier, et qui entraine l’arrêt de la transformation, s’appelle le réactif limitant. Le réactif qui
n’est pas entièrement consommé à la fin de la transformation est le réactif en excès.
L’avancement maximal xmax est la valeur de l’avancement qui annule la quantité de matière du réactif limitant.
2. Détermination
Pour déterminer l’avancement maximal et le réactif limitant :

- On suppose successivement que chacun des réactifs est limitant et on calcule la valeur de xmax qui annule la
quantité de matière de ce réactif dans l’état final.
Ex. Si on suppose que I2 est limitant ; n ( I2(aq) ) – xmax = 0 donc xmax = n ( I2(aq) )
Ex. Si on suppose que S2O32- est limitant ; n (S2O32-(aq)) - 2xmax = 0 donc xmax = 𝐧( 𝐒𝟐𝟎𝟑
𝟐−(𝐚𝐪) )
𝟐
- La valeur de xmax est égale à la plus petite des valeurs calculées. On en déduit alors le réactif limitant.
Ex. Si n ( I2(aq) )i < 𝐧( 𝐒𝟐𝟎𝟑
𝟐−(𝐚𝐪))𝐢
𝟐 alors I2(aq) est le réactif limitant et xmax = n ( I2(aq) )i.
Si n ( I2(aq) )i > 𝐧( 𝐒𝟐𝟎𝟑
𝟐−(𝐚𝐪) ) 𝐢
𝟐 alors S2O32-(aq) est le réactif limitant et xmax = 𝐧( 𝐒𝟐𝟎𝟑
𝟐−(𝐚𝐪) )𝐢
𝟐.
Remarque : si tous les réactifs sont consommés à l’état final, on dit qu’ils ont été introduits dans les proportions
stœchiométriques.
Ex. Si xmax = n ( I2(aq) )i = 𝐧( 𝐒𝟐𝟎𝟑
𝟐−(𝐚𝐪) ) 𝐢
𝟐 alors I2(aq) et S2O32-(aq) sont les réactifs limitants.
V-. Bilan de matière
Faire un bilan de matière d’un système consiste à calculer les quantités de chaque espèce chimique soit dans l’état
initial, soit en cours de réaction soit dans l’état final.
1
/
2
100%