30/11/2015 LE BOHEC Blandine L2 CR : Orianne DODIER

GENETIQUE MEDICALE – Diagnostic indirect et haplotypes
30/11/2015
LE BOHEC Blandine L2
CR : Orianne DODIER
Génétique médicale
C. BEROUD
14 pages
Étude de ségrégation, ED de génétique moléculaire (haplotypes ; interprétation de données
mutationnelles ; notion de bioinformatique ; mucoviscidose)
Diagnostic indirect et haplotypes.
Plan
A. A. Démarche diagnostique dans les maladies génétiques
B.
C. B. Diagnostic moléculaire des maladies génétiques : cas du diagnostic indirect
I. Définitions
II. Principe
III. Marqueurs microsatellites
IV. Exemples
V. Notion d'informativité
VI. Notion de recombinaisons
VII. Haplotype :
a. Principe
b. Les différentes étapes
c. Exercices
VIII. Applications
IX. Exercices
A. Démarche diagnostique dans les maladies génétiques
L'interrogatoire et l'examen
clinique associés à des examens
complémentaires, qui ne sont pas
forcément génétiques (biochimie,
imagerie...), permettent d'aboutir
à un diagnostic clinique. Le but
de l'analyse génétique va être de
confirmer ou non ce diagnostic
clinique.
1/14

GENETIQUE MEDICALE – Diagnostic indirect et haplotypes
B. Diagnostic moléculaire des maladies génétiques : cas du diagnostic indirect
On peut faire des analyses de cytogénétique (caryotype standard, FISH...) ou de génétique moléculaire :
•soit par diagnostic direct : séquençage du gène et recherche de l'anomalie génétique primaire ; ce qui
est de plus en plus fait à l'heure actuelle ;
•soit par diagnostic indirect : analyse de ségrégation des marqueurs en essayant de connaître le locus de
l'anomalie et d'analyser son mode de ségrégation dans une famille par des haplotypes. Cette méthode a
été utilisée pendant de nombreuses années quand on connaissait les gènes (on savait à peu près ou ils
étaient), mais qu'on ne savait pas aller chercher directement la mutation dans le gène.
L'objectif du diagnostic moléculaire est d'établir un diagnostic précis par l'identification de l'anomalie
génétique. Cela a un intérêt de certitude diagnostique pour permettre une prise en charge adaptée (les
recommandations de certaines mutations ne sont pas les mêmes en terme de suivi) et un conseil
génétique adéquat (risque d'être porteur, risque de récurrence...).
Il y a deux approches :
•diagnostic direct qui consiste en la recherche de l'anomalie génétique primaire permettant
l'identification de mutations constitutionnelles délétères.
•diagnostic indirect qui à l'aide de marqueurs informatifs (haplotypes) va permettre d'étudier la
coségrégation d'un phénotype avec un allèle particulier dans une famille.
Dans le diagnostic direct, on a donc un individu auquel on fait des analyses, alors que dans le diagnostic
indirect il faut disposer d'une famille suffisamment grande pour avoir des sujets sains et des sujets malades afin
de savoir quel est l'haplotype qui ségrège avec la maladie.
Dans ce cours, on ne s'intéresse qu'au diagnostic indirect.
Actuellement, on utilise le diagnostic indirect dans certaines situations particulières (très restreintes) :
•diagnostic prénatal de certaines maladies (recherche de la mutation causale) : plutôt en complément de
l'étude directe (par exemple, pour un avortement, la responsabilité est très grande donc il faut être sûr du
diagnostic).
•diagnostic pré-implantatoire : analyse d'une seule cellule afin de savoir si le fœtus a hérité ou pas du
marqueur pathologique ou de l'haplotype morbide (faire du séquencage sur une cellule n'est pas possible
en raison de la trop faible quantité d'ADN donc l'analyse directe est impossible dans ce cas).
La technique est aussi utilisée pour :
•la vérification de l'identité d'un échantillon : par exemple, quand on réalise un diagnostic prénatal,
cette technique permet de confirmer que le prélèvement réalisé (de trophoblaste ou de liquide
amniotique) est bien celui du fœtus et non celui de la mère par contamination (car le prélèvement peut
être sanglant) ;
•les empreintes génétiques ;
•d'autres applications.
L'utilisation de marqueurs pour analyser la coségrégation marqueur/maladie nécessite de :
•connaître la localisation du gène morbide : si on ne connaît pas le locus du gène, on ne peut aller
trouver les marqueurs de polymorphisme qui vont l'entourer ;
•connaître des marqueurs polymorphes localisés à proximité ou dans le gène ;
•étudier la coségrégation familiale phénotype/marqueur : il faut que les marqueurs ségrègent toujours
avec la maladie.
2/14

GENETIQUE MEDICALE – Diagnostic indirect et haplotypes
Tout cela permet donc de réaliser un suivi indirect
de la transmission d'une mutation dans une famille.
Ainsi, pour chaque famille, l'étude va être différente.
Les principales contraintes sont :
•la nécessité de connaître le gène impliqué (ou le locus) pour choisir les marqueurs à utiliser (le problème
se pose s'il y a hétérogénéité génétique).
•la nécessité d'avoir une certitude du diagnostic clinique chez les sujets.
•la nécessité d'une étude familiale.
•la nécessité d'avoir une famille suffisamment grande pour qu'elle soit « informative », c'est à dire qu'il
faut avoir accès aux autres personnes de la famille et que c'est parfois non concluant.
•le risque d'erreur ou d'impossibilité de conclure en cas de recombinaison (ségrégation du marqueur d'un
côté et la mutation de l'autre alors qu'il sont liés chez tous les autres individus).
I. Définitions
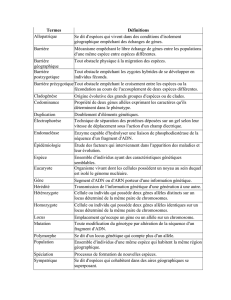
Locus : emplacement sur un chromosome (d'un gène, d'une séquence...).
Allèle : une ou plusieurs versions alternatives d'un même gène, d'une même séquence d'ADN. S'applique aux
mutations, aux polymorphismes, aux marqueurs génétiques...
Exemples : pour un gène, allèle sauvage et allèles mutés ; pour un marqueur, différentes tailles (allèle de 8
répétitions, allèle de 2 répétitions, etc). Un marqueur est d'autant plus informatif qu'il a de nombreux allèles.
Hétérozygote : un individu est hétérozygote pour un locus lorsqu'il possède deux allèles différents à ce locus.
Homozygote : un individu est homozygote pour un locus lorsqu'il possède deux allèles identiques à ce locus.
Hémizygote : un individu est hémizygote pour un locus lorsqu'il possède un seul allèle à ce locus (cas du
chromosome X chez l'homme).
Génotype : ensemble des allèles à un ou plusieurs locus chez un individu.
Haplotype : arrangement linéaire ordonné des allèles sur un chromosome.
3/14

GENETIQUE MEDICALE – Diagnostic indirect et haplotypes
A, B, C : locus de polymorphisme.
Lorsque l'on a des résultats bruts, on ne sait pas si on a A2 B2 C2 ou A2 B1 C2 ou A3 B1 C2, etc. On sait juste
que l'individu a ces deux marqueurs mais on ne sait pas lequel est situé sur un allèle et lequel est situé sur
l'autre.
Le but est de reconstruire ces haplotypes pour savoir dans quels alignements ils sont.
Les allèles proches sont transmis ensemble (« en bloc ») sauf s'il y a une recombinaison méiotique entre
deux locus.
II. Principe
Les outils utilisés sont des marqueurs génétiques « anonymes ». Ce sont des variations polymorphes de la
séquence d'ADN, répartis uniformément sur le génome et de localisation connue, n'ayant pas d'effet direct sur
le phénotype. Il faut sélectionner des marqueurs à proximité du gène/locus ou dans le gène/locus morbide
impliqué (les marqueurs peuvent donc être intragéniques ou extragéniques). Quand on a le choix il est
préférable de choisir un marqueur intragénique car il y moins de risque de recombinaison.
CR : les marqueurs n'ont pas
d'effet pathologique. Ils sont
utilisés pour suivre
directement ou indirectement
la transmission d'une
mutation (connue ou non)
dans une famille).
Il existe différents types de marqueurs :
•Microsatellites (ou Short Tandem Repeats : STR) : polymorphismes de répétitions, répartis
uniformément dans le génome, tous les 25 à 100 kb. Ce sont ceux qui sont le plus utilisés car souvent on
est multi-allélique et non homozygote pour ces régions là (marqueurs de choix).
•Single Nucleotide Polymorphism (SNP) : polymorphismes au niveau d'un nucléotide, très abondants (1
SNP/1 kb), on en connaît plus de 1,5 millions, ils sont répartis uniformément dans le génome et bi-
alléliques.
•Restriction Fragment Lenght Polymorphisms (RFLP) : polymorphismes de restriction. Il s'agit de
marqueurs de polymorphismes qui réagissent avec des enzymes de restriction. C'est aussi un marqueur
bi-allélique (s'apparente aux SNP).
•Autres : délétions, insertions...
Il faut retenir que la plupart du temps ce sont les microsatellites qui sont utilisés.
III. Les marqueurs microsatellites
Le choix de la région d'intérêt dépend du diagnostic clinique et des connaissances. On sélectionne les
marqueurs de polymorphisme (marqueurs informatifs dans la famille) puis on procède à une amplification des
régions par PCR de ces marqueurs ce qui permet d'obtenir des quantités suffisantes des séquences d'intérêt pour
permettre leur détection (1 cellule contient environ 7 pg d'ADN donc il faut amplifier les régions d'intérêt car
sinon elles sont indétectables). L'analyse des produits amplifiés permet ainsi la détection des allèles (selon la
taille des produits amplifiés) et la détermination du génotype.
4/14

GENETIQUE MEDICALE – Diagnostic indirect et haplotypes
Les microsatellites sont des séquences d'ADN répétées en tandem, d'un motif de 2 à 10 pb et dont la taille totale
est inférieure à 100 pb. Plus le motif est grand, plus le produit amplifié sera grand et moins ce sera pratique.
Ils sont très polymorphes et répartis uniformément
sur l'ensemble du génome, principalement dans les
séquences intergéniques et intragéniques (rarement
dans les séquences codantes) et constituent
d'excellents marqueurs génétiques.
On sépare les allèles en fonction de leur taille.
On détermine le statut de chaque individu pour le marqueur étudié :
1 bande (ou 1 pic) si c'est un homozygote, 2 bandes (ou 2 pics) si c'est un hétérozygote.
Pourquoi la technique de séquençage n'est-elle pas utilisée ? Car c'est beaucoup plus compliqué à interpréter
lorsque l'on a des allèles différents (l'un avec 12 répétitions et l'autre 15 répétitions par exemple), le risque
d'erreur est donc accru.
Dans quelle situation est-elle intéressante ? Sur le chromosome X chez un homme (car hémizygote donc il n'y a
qu'un seul allèle)
La séparation des allèles est réalisée en fonction de leur taille (c'est une électrophorèse, l'ADN migre vers le +
car il est chargé négativement).
Diagnostic moléculaire indirect : récapitulatif
Il s'agit d'une étude au niveau de la liaison marqueurs-maladie avec utilisation de marqueurs polymorphes
intragéniques ou extragéniques pour analyser la coségrégation d'un phénotype avec un allèle particulier dans
une famille.Il repose sur des méthodes de PCR de marqueurs situés dans ou à proximité du locus morbide (si
possible) afin de minimiser les risques d'erreurs dus à des événements de recombinaison. Les marqueurs
microsatellites sont vraiment des marqueurs de premier choix.
5/14
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%