FICHE 2 / ADAPTATION DE L`APPORT D`OXYGENE AU

FICHE 2 / ADAPTATION DE L’APPORT D’OXYGENE AU METABOLISME TISSULAIRE
Introduction
Les cellules tirent leur énergie de l'hydrolyse de l'ATP en ADP, Phosphate inorganique et ions H+.
L'ATP est ensuite régénérée dans les mitochondries à partir de ces métabolites, en présence d'oxygène moléculaire (O2).
Conditions aérobies
Conditions anaérobies
- moyen le plus efficace de produire de l'ATP : phosphorylation
oxydative (substrat = glucose)
- dans cytosol (glycolyse) puis mitochondrie (cycle de Krebs et
phosph. Oxydative)
- 36 ATP / glucose
- nécessite un apport d’O2
- glycolyse puis fermentation lactique
- dans cytosol
- 2 ATP / glucose
Apports et consommation d’O2
Fonction poumons + cœur + vaisseaux : assurer un apport continu et adapté d'O2 et de substrats aux tissus pour maintenir l'intégrité et la
fonction des cellules qui les composent.
Transport d’oxygène : succession de processus convectifs et diffusifs

Convection
transport de substances dissoutes par un
courant liquide ou gazeux
Diffusion
Localisation
- air au niveau des poumons
- sang dans la circulation
- membrane alvéolo-capillaire (air alvéolaire
vers sang)
- dans les tissus (sang vers cellules)
Loi
Jconv = Jv x C
Loi de Fick :
Vgaz = α.S.D.(P1-P2)/E
D = α.Sol/√PM
Proportionnalité
- débit de fluide liquide ou gazeux (Jv)
- concentration de substance (C)
- surface d’échange (S) ; S≈70m2 pour la barrière
alvéolo- capillaire
- différence de pression partielle du gaz (P1-P2)
- constante de diffusion D
- solubilité du gaz (Sol) ; SolO2 faible (≈20 fois
inférieure à celle du CO2)
Proportionnalité inverse
- épaisseur (E) ; Emembrane alvéolo-cap. = 0.2 à 1 μm
- racine du poids moléculaire du gaz (PM)
Contenu en oxygène du sang : 2 formes (dissous et combiné avec l’hémoglobine)
Dissous
- proportionnelle à la pression partielle d'O2 (environ 100 mm Hg dans le sang artériel) : O2dissous = Sol x PO2
(Sol = 0.003 mLO2/100mLsang)
- très faible, environ 0,3 ml d'O2 par 100 ml de sang.
- si l’individu respire 100% d’oxygène, la PAO2 est multipliée par 5, le contenu en O2 dissous aussi, mais le
contenu total en O2 dans le sang varie peu (l’hémoglobine est déjà saturée)
Lié à l’hémoglobine
- dépend de la pression partielle d'O2
- très importante, environ 20,8 ml d'O2 par 100 ml de sang.
1 mole d'hémoglobine lie à saturation 4 moles d'O2, et les 15 g d'hémoglobine contenus dans 100 ml de sang
lient 15 x (1 / 64 500) x (22 400 x 4) ml d'O2. [64 500 est le poids moléculaire en g de l'hémoglobine et 22 400 est
le volume en ml occupé par une mole de gaz dans des conditions standard].
- Effet Bohr :
Diminution de l’affinité de l’Hb pour O2 (déplacement à droite de la courbe de dissociation de
l’oxyhémoglobine) : T, PCO2, pH
Muscle en exercice : délivre davantage d’O2 aux tissus

Les facteurs qui affectent l'apport d'oxygène dans les tissus
Facteurs
Mécanisme
Origine
Cause
Hypoxie
Caractéristiques
Pulmonaires
Modification
perfusion
nventilatio
R
Normal : 1
Alvéolaire (R<1)
Hypoventilation
alvéolaire (bronchite) :
effet shunt (la perfusion
ne sert à rien)
hypoxémique
contenu en O2 du
sang car la PO2 diminue
Capillaire (R>1)
Absence de perfusion
alvéolaire : effet espace
mort
Membrane
alvéolo-capillaire
Obstacle à la diffusion
(épaississement par
fibrose) : effet shunt +
espace mort
Circulatoires
Modification du
débit d’O2 sanguin
DO2 = Q x CaO2
Q
Insuffisance cardiaque
ou trouble de la
circulation locale
Ischémique
Lié à la circulation
sanguine
Hb
Anémie
Anémique
Lié à la Hb
Tissulaires
Modification de la
diffusion d’O2 vers
les tissus
distance
capillaire/ cellule
Expansion tissulaire (ex :
tumeurs)
Géographique
Les cellules situées le
plus loin des capillaires
sont – approvisionnées
Utilisation de l’O2
par les tissus
utilisation O2
dans les
mitochondries
Cyanure / acide
cyanidrique
Cytotoxique
Complexe cytochrome
oxydase bloqué dans la
chaîne respiratoire
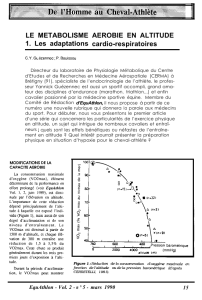
Adaptation de l’apport d’oxygène
Locale
Systémique
Hyperhémie réactive
Mise en évidence
expérimentale :
En clampant pendant
quelques secondes l'artère
fémorale: lorsque l'occlusion
est levée, il apparaît une
hyperhémie réactive,
immédiate, transitoire,
d'autant plus longue que
l'occlusion a été prolongée.
Hypoxie ischémique
Rapide
Voie réflexe : glomus carotidien
Capteurs :
- en contact avec le sang sont situées au niveau de la division des artères carotides
communes (glomus carotidien) et de la crosse aortique (glomus aortique)
- cellules de type I : elles possèdent des granules cytosoliques contenant de nombreux
neuromédiateurs comme la dopamine, la noradrénaline et l'acétylcholine) enveloppées par
les extensions des cellules de type II
- cellules de type II : cellules de soutien de type glial
Mise en évidence : chez l’animal par inhalation de 2 volumes courants d’O2 au cours de la respiration
d’un mélange hypoxique
Hypoxie hypoxémique
Rapide, peu sensible (seuil de 60 mmHg)
Gènes contrôlés par HIF-1
L'hypoxie expression d'une grande diversité de gènes (séquence enhancer spécifique, qui est
sensible à l'hypoxie et qui a été nommée HRE ; la séquence fixe en condition d'hypoxie un complexe
protéique nommé HIF-1)
HIF-1 : 2 unités, α et β, dont les gènes qui les codent sont exprimés de façon constitutive et stable dans
la plupart des cellules.

Correction lente
Enzymes de la
glycolyse
enzymes de la glycolyse et transporteurs du glucose métabolisme anaérobie
Hypoxie cytotoxique
Vasodilatation
expression de 2 enzymes, la nitric oxide synthase (iNOS) et l'hème oxygénase 1
(HO-1), qui produisent 2 substances vasodilatatrices, respectivement le NO et le
CO
Hypoxie ischémique
Erythropoïèse
- facteur de croissance qui est produit principalement dans le rein et à
un moindre niveau dans le foie (transcription du gène codant pour
l'érythropoïétine requiert la liaison en position 3' non codante de HIF-
1 mais aussi de HNF-4, protéine présente exclusivement dans le cortex
rénal et le foie
- se lie dans la moelle osseuse à des cellules cibles, les précurseurs
érythrocytaires, et stimule ainsi la production de globules rouges
- efficacité dépend de la liaison à un récepteur de la famille des
récepteurs de facteurs de croissance hématopoïétique et de
l'activation d'une voie de signalisation
- protéines cibles mobilisées incluent la PI3 kinase (inhibe l'apoptose) et
STAT 5 (stimule la prolifération cellulaire)
Hypoxémie anémique
Angiogénèse
- expression d'un facteur angiogénique, le VEGF (entraîne la formation
d'un bourgeon endothélial, puis la formation et la survie de vaisseaux
immatures)
- C'est seulement lorsque ces vaisseaux sont entourés de péricytes, de
cellules musculaires lisses et d'une membrane basale qu'ils
deviennent indépendants du VEGF.
Hypoxémie géographique
1
/
4
100%