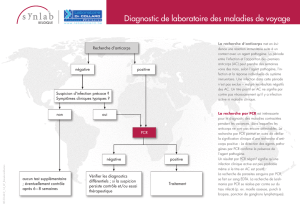
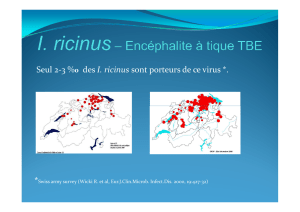
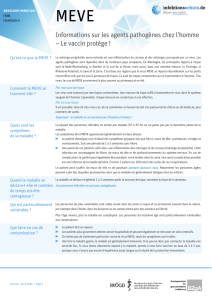
Télécharger la fiche technique [176.59 Ko PDF]

GLOBE (Global Link for Online Biomedical Expertise) Manuel Contrôle des Maladies Transmissibles
1/4
CIM-9 088.8 ; CIM-10 B60.0
©Fondation Mérieux 2010. Tous doits réservés.
Babésiose (Piroplasmose)
CIM-9 088.8 ; CIM-10 B60.0
CCDM19 : B. Herwaldt
CCDM18 : F. Meslin, K. Western
1. Identification
Une infestation zoonotique due à un parasite protozoaire intra-érythrocytaire du genre Babesia. Le
spectre clinique va d’asymptomatique à mortel, ce qui dépend en partie de facteurs dus à l’hôte
et au parasite. Dans sa manifestation clinique, l’infestation par Babesia provoque de la fièvre, des
symptômes non-spécifiques de type grippal et une anémie hémolytique. Communément le tableau
clinique présente une fièvre, des frissons, une myalgie, une fatigue et une jaunisse ssecondaire à
l’anémie hémolytique pouvant durer de quelques jours à quelques mois. Des études de
séroprévalence indiquent que la plupart des infections sont asymptomatiques. Même les personnes
infestées mais asymptomatiques présentent une parasitémie de faible intensité (sous le seuil de
détection), parfois pour plus d’un an, rendant la transmission par transfusion sanguine un problème.
Une infestation combinée avec Borrelia burgdorferi, l’agent causal de la maladie de Lyme peut
rendre les deux maladies plus graves.
Le diagnostic des cas aigus de parasitémie s’effectue par identification au microscopie optique des
parasites intra-érythrocytaires Babesia sur des frottis sanguins colorés par Wright ou Giemsa. Dans
certaines circonstances, il peut être difficile de faire la différence entre les espèces de Babesia et
de Plasmodium falciparum. Certaines espèces de Babesia (par ex. B. Microti et B. duncani) ne
peuvent être distinguées morphologiquement les unes des autres. La confirmation du diagnostic/de
l’espèce par un laboratoire de référence – par examen d’un frottis ou d’autre moyen (par ex. Test
sérologique, analyse moléculaire, inoculation animale) doit être envisagée.
2. Agents infectieux
Il est établi que plusieurs espèces provoquent la maladie chez l’humain, certaines d’entre elles
n’ayant été identifiées ou caractérisées que récemment. Aux USA, il s’agit de façon prédominante
de Babesia microti (voir Prévalence), mais aussi B. duncani (autrefois parasite de type WA1) et dans
plusieurs états de l’ouest des USA d’autres microorganismes apparentés, ainsi que des parasites de
type B. divergens. En Europe, la liste comprend : B. divergens, EU1, et B. microti. Dans d’autres
régions, celle-ci comprend diverses espèces et souches de Babesia.
3. Prévalence
Mondiale, dispersée. Globalement, la plupart des cas zoonotiques documentés se sont produits aux
USA, certains en Europe et quelque uns dans d’autres régions. Cependant, avec la connaissance
croissante des espèces de Babesia nouvellement recensées, les profils de cas documentés
pourraient changer.
19ème Edition - 2008
Manuel - Contrôle des Maladies Transmissibles

GLOBE (Global Link for Online Biomedical Expertise) Manuel Contrôle des Maladies Transmissibles
2/4
CIM-9 088.8 ; CIM-10 B60.0
©Fondation Mérieux 2010. Tous doits réservés.
Aux USA, la plupart des cas ont été attribués à B. microti et acquis dans les états du nord-est (en en
particulier, mais pas exclusivement dans certaines zones du Connecticut, Massachusetts, New
Jersey, New York, et Rhode Island) et dans une moindre mesure dans la partie supérieure du
Midwest (Wisconsin et Minnesota). En Europe, des infestations humaines dues à B. divergens ont été
notifiées en France, Allemagne, Irlande, Russie, Serbie et Monténégro (ancienne République de
Yougoslavie), Espagne, Suède et au Royaume Uni (Écosse). Des infestations humaines avec des
espèces moins bien caractérisées ont aussi été notifiées en Chine (y compris à Taiwan), en Égypte,
au Japon, en Espagne (dans les îles Canaries) et en Afrique du Sud.
4. Réservoir
La souris à pattes blanches (Peromyscus leucopus) et d’autres petits mammifères pour B. microti aux
USA ; le bétail pour B. divergens en Europe ; pas encore fermement établi pour les autres espèces
zoonotiques de Babesia.
5. Mode de transmission
Naturellement transmise par une tique bien que la piqûre de tique ne soit typiquement pas
remarquée et que la tique vecteur n'ait pas été identifiée pour certaines espèces de Babesia. Les
vecteurs incluent Ixodes scapularis pour B. microti aux USA (typiquement au stade de nymphe, de la
fin du printemps jusqu’au début de l’automne) et I. ricinus pour B. divergens en Europe. Les tiques
Ixodes au stade de nymphe se nourrissent habituellement sur des souris à pattes blanches
(Peromyscus leucopus) et d'autres petits mammifères (par ex. campagnols, Microtus
pennsylvanicus) infectés. La tique adulte se trouve normalement sur les cerfs (qui ne sont pas
infestés par le parasite) mais peut aussi se nourrir sur d’autres mammifères ou des hôtes aviaires.
L’espèce Babesia se transmet aussi par transfusion sanguine (documentée pour B. microti et B.
duncani) ; la transmission par transfusion n’est pas en soi limitée en terme de zone géographique ni
de saison. Il existe quelques rares cas de transmission congénitale/périnatale.
6. Période d’incubation
Variable, dépendant en partie de l’hôte, du parasite et de facteurs épidémiologiques. Autour
d'une à 3 semaines ou plus pour la transmission par une tique et de quelques semaines à plusieurs
mois pour la transmission par voie sanguine. Les symptômes peuvent apparaitre ou connaitre une
recrudescence plusieurs mois (même >1an) après l’exposition initiale, en particulier si la personne est
immunodéprimée
7. Période de contagion
Aucune transmission de personne à personne excepté dans le cas de transfusion sanguine, ce qui
peut se produire des mois jusqu’à >1 ans après que le donneur ait été infecté. Une parasitémie
asymptomatique non diagnostiquée peut être de longue durée.
8. Prédisposition
Il est supposé que la prédisposition à B. microti est universelle. Les personnes aspléniques,
immunodéprimées, âgées ou affaiblies d’une autre manière présentent un risque accru de
manifester l’infection clinique, qui peut être grave.

GLOBE (Global Link for Online Biomedical Expertise) Manuel Contrôle des Maladies Transmissibles
3/4
CIM-9 088.8 ; CIM-10 B60.0
©Fondation Mérieux 2010. Tous doits réservés.
9. Méthodes de contrôle
A. Mesures préventives
1) Transmission par les tiques (dans les régions endémiques à Babesiosis) : Éduquer le public sur les
mesures individuelles de protection pour réduire le risque de piqûres par tiques. Contrôler les
rongeurs autour des habitations humaines et utiliser des répulsifs tiques. Voir maladie de Lyme 9A et
rickettsioses transmises par les tiques 9A.
2) Transmission par le sang : Aucun test n’existe pour dépister la présence de Babesia lors des dons
du sang.
B. Contrôle du patient, des contacts et de l'environnement immédiat
1) Notification de cas à l'autorité sanitaire locale : Notification de nouveaux cas suspects dans
certains pays, en particulier dans des régions qui ne sont pas considérées endémiques à l'heure
actuelle, Classe 3 (voir Déclaration).
2) Isolement : Précautions contre le sang et les fluides biologiques.
3) Désinfection concomitante : Non applicable.
4) Quarantaine : Non applicable.
5) Protection des contacts : Si indiqué par l’épidémiologie et le contexte clinique (voir n°6 ci-
dessous), évaluer les autres personnes pouvant avoir été contaminées dans les mêmes
circonstances que le patient.
6) Enquête sur les contacts et la source de l'infection : Des cas se produisant dans une nouvelle
région nécessitent une étude attentive (par ex. identifier/caractériser l’espèce Babesia, les tiques
vecteur et les hôtes réservoir). L’enquête sur les cas acquis par transfusion sanguine nécessite une
attention médicale de santé publique : Le donneur sanguin impliqué doit être examiné et mis à
l’écart de futures donations et les receveurs de produits sanguins de tous les dons correspondants
doivent être rapidement évalués.
7) Traitement spécifique : Une combinaison de clindamycine et quinine est le traitement habituel
pour une infestation grave par B. microti. Dans des essais cliniques contrôlés réalisés chez des
adultes avec des infestations ne mettant pas en danger leur pronostic vital, une combinaison
d’atovaquone et d'azithromycine a présentée une efficacité comparable à combinaison
clindamycine et quinine, et était mieux tolérée. Des rapports sur des cas isolés font état de réussites
avec d'autres combinaisons médicamenteuses (par ex. atovaquone plus quinine). En complément,
un échange transfusionnel doit être envisagé pour les patients dans un état critique,
particulièrement, mais non exclusivement, pour ceux dont une large proportion des globules rouges
est parasitée (par ex. >10%). Certains patients nécessitent une dialyse et une ventilation artificielle. Si
indiqué par le contexte épidémiologique et clinique, considérer la possibilité d’une co-infestation
avec Borrelia burgdorferi (maladie de Lyme) ou Anaplasma phagocytophilum (anaplasmose
granulocytique humaine) Une dialyse peut être nécessaire pour les patients avec une insuffisance
rénale.

GLOBE (Global Link for Online Biomedical Expertise) Manuel Contrôle des Maladies Transmissibles
4/4
CIM-9 088.8 ; CIM-10 B60.0
©Fondation Mérieux 2010. Tous doits réservés.
C. Mesures épidémiologiques
Aucune.
D. Conséquences pour la gestion de catastrophes
Aucune.
E. Mesures internationales
Aucune.
1
/
4
100%
![Télécharger la fiche technique [176.71 Ko PDF]](http://s1.studylibfr.com/store/data/004890620_1-8556133a65141458896523333f90b17a-300x300.png)