ue5-pelluard-le-coeur-et-les-vaisseaux-histo-et

UE5 – Pelluard
Le cœur et les vaisseaux : embryologie et histologie
I. Introduction et généralités
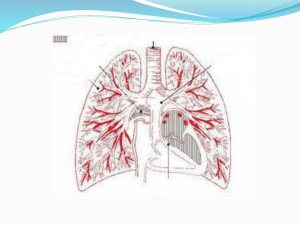
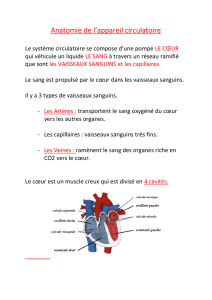
1. La circulation sanguine
La circulation sanguine c'est :
- le cœur
- les artères (partent du cœur et redistribuent le sang dans l'organisme)
- les veines
- les capillaires (zones d'échange entre le compartiment sanguin et les tissus et inversement)
La quasi-totalité des territoires de l'organisme sont concernés par cette circulation sanguine,
même s’il existe de rares territoires de l’organisme qui ne sont pas vascularisés (cette non
vascularisation est nécessaire à leur bon fonctionnement : épithéliums, cornée, cartilage)
Tous les vaisseaux du corps ont pour caractéristique d’être bordés par un endothélium.
Cette circulation sanguine peut être subdivisée en 2 parties : la circulation systémique et la
circulation pulmonaire.
La circulation sanguine est différente chez le fœtus et évolue le long de la gestation jusqu’à la
mise en place des 2 circulations à la naissance. En effet, le fœtus étant dans la cavité
amniotique ce dernier n’a pas besoin d’utiliser ses poumons.
Les fonctions de cette circulation sont multiples :
- Transport et échanges O2/CO2 (au niveau du poumon, indispensable à tous les tissus)
- Transport et échange de nutriments, déchets, ions
- Cellules sanguines : GR, plaquettes, leucocytes.
- Cellules immunitaires
- Messagers chimiques (hormones, cytokines, facteur de croissance)

II. Embryologie du système cardio-vasculaire
1. Rappels embryologiques
Chronologie :
Fécondation : dans le tiers externe de la trompe
1ère semaine : l’œuf arrive au niveau de l’utérus, il s’implante et a besoin de « se nourrir ». Il
s’opère donc une digestion trophoblastique autour de l’œuf dans la muqueuse utérine. Par
diffusion, les premiers éléments sont échangés entre la muqueuse et l’œuf.
3ème semaine : apparition d’amas (ou îlots) angioformateurs (ébauche de la
vascularisation) et de l'ébauche cardiaque. Les premiers vaisseaux de l'organisme.
4ème semaine : Premiers battements cardiaque (circulation qui commence à l’intérieur de
l’embryon mais aussi jusqu’au placenta qui reflète les échanges avec la mère). Les battements
cardiaques sont évidemment différents de ceux chez l’adulte du notamment à la différence
d’anatomie (cœur à 4 cavité et circulation différente). Au départ le cœur chez l’embryon n’est
qu’un tube muni de cellules myocardiques permettant la progression du sang.
De plus, la 4ème semaine marque le début du cloisonnement du cœur qui va lui permettre de
devenir petit à petit un cœur à 4 cavités.
24ème semaine (= 6ème mois) : hématopoïèse définitive.
Naissance : fermeture du canal artériel et du foramen ovale - étape critique et
fondamentale dans l'évolution du système cardio-vasculaire.
Tout au long de la vie embryonnaire sont mis en place 3 shunts physiologiques. Ces 3 shunts
(canal d’Arantius, canal artériel et foramen oval) sont fermés à la naissance et permettent la
circulation de type adulte.
- Avant la naissance, on a une hémodynamique qui est spécifique à l’embryon, puis au fœtus :
les phénomènes d'apports gazeux (oxygénation) et nutritionnel sont assurés par le placenta, il
n'y a pas d'hématose pulmonaire et la circulation reste interne au fœtus.
- La naissance change fondamentalement l'hémodynamique en séparant le système cardio-
vasculaire du nouveau-né du placenta et en établissant les circulations artérielle et veineuse
définitives, avec le début du phénomène d'hématose à la 1ère inspiration.
- La naissance est une étape clé dans l'organisation du système cardio-vasculaire. C'est à ce
moment que peuvent se révéler des malformations.

Schéma : Fin de la 3ème semaine (gastrulation puis délimitation = courbure de l’embryon
latéralement et de façon antéropostérieur) : présence d’amas angio-formateurs au niveau de la
paroi de la vésicule vitelline qui font apparaître les vaisseaux et les cellules sanguines :
- la paroi de la vésicule vitelline
- le pédicule embryonnaire préfigurant les vaisseaux ombilicaux allant au placenta,
- la zone cardiogène (ébauche du cœur), c'est-à-dire la zone la plus antérieure de l'embryon
tridermique. Techniquement le futur cœur est sur la tête (à ce stade). C’est grâce à la
délimitation que le cœur va se retrouver au niveau de la poitrine.
A ce stade, on a la préfiguration de ce qui va être les trois vascularisations durant les périodes
embryonnaire et fœtale :
- Une vascularisation à l'intérieur de l'embryon : qui va constituer les 2 aortes (ventrales et
dorsales) paires et symétriques par rapport à la ligne médiane, reliées par les arcs aortiques et
les veines cardinales.
- Une vascularisation extra-embryonnaire: en particulier avec la vésicule vitelline (=
vascularisation vitelline),
- Une vascularisation qui relie l'embryon au placenta avec le pédicule embryonnaire (=
vascularisation placentaire).

A la fin de la 3ème semaine, l'embryon est tri-dermique (membrane pharyngienne composée
de 2 couches, la membrane cloacale composée de 2 couches) et en train de se délimiter, avec
ses trois feuillets : ectoblaste, mésoblaste, endoblaste. C'est là que se met en place la zone
cardiogène (à la partie la plus antérieure de l’embryon) qui va ensuite basculer en position
ventrale au moment de la neurulation (le moment où va se mettre en place le massif facial).
- On va donc avoir un basculement de la zone cardiogène d'une position antérieure à une
position ventrale qui va devenir progressivement l'ébauche thoracique.
A ce stade, on est au début du 2ème mois, lors du phénomène de délimitation de l'embryon
avec la courbure céphalique : mise en place de l'ébauche cardiaque au niveau de ce qui va
devenir le thorax.

L’ébauche cardiaque se met donc en place petit à petit à l’intérieur de l’embryon pour se
développer à l’intérieur d’une cavité (le futur péricarde).
L’embryon repose sur la vésicule vitelline et, grâce à la délimitation, une partie de cette
vésicule va intégrer l’embryon et son toit va permettre de former l’intestin antérieur, moyen et
postérieur dans sa partie antérieure, moyenne, et postérieure respectivement.
Très vite, à la fin du premier mois, on a :
- une ébauche cardiaque située en position thoracique et qui a déjà des battements
cardiaques (donc qui permet déjà une circulation sanguine). Le tube cardiaque est formé d’un
pôle artériel (qui donnera le tronc artériel) au niveau céphalique, et d’un pôle veineux (qui
donnera le sinus veineux) au niveau caudal. Les 2 tubes vont fusionner sur la ligne médiane
pour former le tube cardiaque primitif qui va commencer à battre. Le sang périphérique
arrive au niveau du sinus veineux et partira par le tronc artériel (en passant par les futures
oreillettes et les futurs ventricules)
- une vascularisation intra-embryonnaire
- une vascularisation extra-embryonnaire vitelline (qui est en contact avec l'intra-
embryonnaire) qui est la vascularisation de la vésicule vitelline, constituée des vaisseaux
vitellins. Les vaisseaux vitellins sont très importants au début, ils sont connectés à l'intérieur
de l'embryon.
- une vascularisation ombilicale qui relie la vascularisation intra-embryonnaire au placenta,
à travers la présence de 2 artères ombilicales et d'une veine ombilicale qui se développe dans
le pédicule embryonnaire (à l’arrière de l’embryon). A l'extrémité des vaisseaux ombilicaux,
dans le placenta, se trouve l'interface entre le sang embryonnaire puis fœtal et le sang
maternel au niveau des villosités choriales (sang fœtal) et de la chambre intervilleuse (sang
maternel). C'est à cet endroit que se font les échanges gazeux et métaboliques nécessaires au
développement embryonnaire puis fœtal.
A ce stade et à cette période, l'ensemble du dispositif est en place. A partir du 1er mois, il va
évoluer avec :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%