Le coeur et les vaisseaux: Histologie et embryologie

1/48
UE 5 – Système cardio-vasculaire
Date : 07/09/2015 Plage horaire : 08h30 – 10h30
Promo : P2 2015-2016 Enseignant : Pr F. PELLUARD
Ronéistes :
BARRUOL Emile
BENAVENTE Nina
Le coeur et les vaisseaux:
Histologie et embryologie
I. Introduction et généralités
1. La circulation sanguine
2. La circulation lymphatique
II. Embryologie du système cardio-vasculaire
1. Rappel embryologique
2. Le développement du cœur
3. Le développement des vaisseaux
A. Évolution des arcs aortiques et des aortes
primitives
B. Réseau veineux primitif
C. Hématopoïèse et angiogenèse
4. Modifications hémodynamiques à la naissance

2/48
A. Circuit du sang avant la naissance
B. Modifications hémodynamiques périnatales
5. Malformations
A. Malformations cardiovasculaires: exemples et causes
III. Histologie du cœur
1. Organisation anatomique
2. Structure des cardiomyocytes
A. Structure des cellules et aspect du myocarde.
B. Morphologie du cardiomyocyte
C. Cellule myo-endocrine des oreillettes
D. Les cellules cardionectrices (le tissu nodal)
3. Innervation – Vascularisation
A. Innervation
B. Vascularisation
4. Histophysiologie : la contraction
A. Initiation de la contraction et conduction
B. La contraction
5. Introduction à la pathologie

3/48
I. Introduction et généralités
1. La circulation sanguine
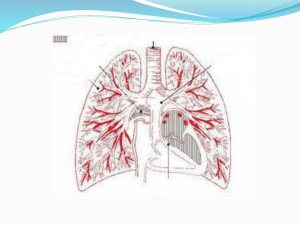
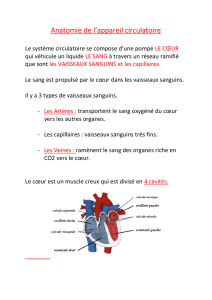
C'est :
− le cœur
− les artères (partent du coeur et redistribuent le sang dans l'organisme)
− les veines
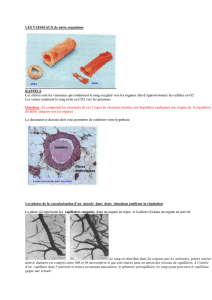
− les capillaires (zones d'échange entre le compartiment sanguin et les tissus, et
inversement)
La quasi-totalité des territoires de l'organisme sont concernés par cette circulation sanguine,
même s’il existe de rares territoires de l’organisme qui ne sont pas vascularisés (cette non
vascularisation est nécessaire à leur bon fonctionnement) : épithéliums, cornée, cartilage -
l’apparition de vaisseaux dans le cartilage signe sa transformation en tissu osseux.
Tous les vaisseaux du corps ont pour caractéristique d’être bordé par un endothélium.
Cette circulation sanguine peut être subdivisée en 2 parties : la circulation systémique et la
circulation pulmonaire.
La circulation sanguine est différente chez le fœtus et évolue le long de la gestation jusqu’à la
mise en place des 2 circulations à la naissance. En effet le fœtus étant dans la cavité amniotique
ce dernier n’a pas besoin d’utiliser ses poumons.
→ Ces tissus échangent donc avec le reste de l'organisme par des phénomènes d'induction.
Les fonctions de cette circulation sont multiples :

4/48
✓ Transport et échanges O2/CO2 (au niveau du poumon, indispensable à quelques tissus
que ce soit)
✓ Transport et échange de nutriments, déchets, ions
✓ Cellules sanguines: GR, plaquettes, leucocytes.
✓ Cellules immunitaires (celles présentes dans le sang ne représentent en réalité qu'une
infime partie de toutes les cellules immunitaires de l'organisme. Elles ne font que
transiter par le sang pour circuler de façon permanente à l'intérieur de l'organisme.
Ces systèmes de transit que l'on détecte par le comptage des polynucléaires, des
lymphocytes et des macrophages dans le sang est un des éléments clé du fonctionnement
du système immunitaire.)
✓ Messagers chimiques (hormones, cytokines, facteur de croissance)
✓ Phénomène hémostase et coagulation, càd d’étanchéité du système vasculaire (donc
transport des facteurs de coagulation)
2. Circulation lymphatique
Etroitement liée au système sanguin dans lequel elle va se déverser, elle est présente dans la
quasi-totalité des tissus. Elle est organisée sous forme de:
− vaisseaux lymphatiques: touchent pratiquement tous les tissus (les cordes vocales et
certains éléments tissulaires n'ont pas de vaisseaux lymphatiques). Ils sont drainés au
niveau de relais lymphatiques:
− ganglions lymphatiques (par exemple les ganglions médiastinaux) dans certains
territoires mais surtout au niveau des hiles des organes.
Dans cette circulation lymphatique circule la lymphe qui contient des lymphocytes, des
polynucléaires et des macrophages. La circulation lymphatique est interconnectée avec la
circulation sanguine : elle s’y déverse. Elle a de nombreuses fonctions:
✓ Fonction immunitaire de défense de l'organisme
✓ Echanges hydrominéraux : en particulier les échanges liquidiens entre les systèmes
lymphatiques et les liquides extra-cellulaires présents à l'intérieur des tissus (oedèmes)
✓ Transport de nutriments : les vaisseaux lymphatiques du tube digestif contribuent au
métabolisme des nutriments qui ont traversé l'epithélium digestif dans les relations entre
la paroi du tube digestif avec le foie.
II. Embryologie du système cardio-vasculaire

5/48
1. Rappels embryologiques
Chronologie :
Fécondation : dans le tiers externe de la trompe
1ère semaine : l’œuf arrive au niveau de l’utérus, et s’implante, et a besoin de « se nourrir ». Il
s’opère donc une digestion trophoblastique autour de l’œuf dans la muqueuse utérine. Par
diffusion, les premiers éléments sont échangés entre la muqueuse et l’œuf.
3ème semaine: apparition d’amas (ou îlots) angioformateurs (ébauche de la vascularisation)
et de l'ébauche cardiaque. Les premiers vaisseaux de l'organisme apparaissent dès la fin du
premier mois à l'extérieur de l'embryon, au niveau de la paroi de la vésicule vitelline.
4ème semaine : Premiers battements cardiaque (circulation qui commence à l’intérieur de
l’embryon mais aussi jusqu’au placenta qui reflète les échanges avec la mère). Les battements
cardiaques sont évidemment différents de ceux chez l’adulte du notamment à la différence
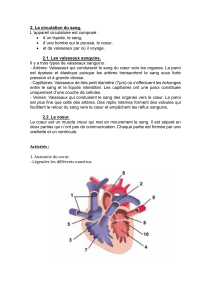
d’anatomie (cœur à 4 cavité, et circulation différente). Au départ le cœur chez l’embryon n’est
qu’un tube muni de cellules myocardiques permettant la progression du sang.
De plus, la 4ème semaine marque le début du cloisonnement du cœur qui va lui permettre de
devenir petit à petit un cœur à 4 cavités.
La formation du cœur débute à la fin du premier mois de développement et se poursuit durant
la période embryonnaire, fœtale et durant la période post-natale, puisqu’on a des
modifications du système cardio-vasculaire à la naissance. Ces modifications sont liées au
clampage du cordon ombilical et au début d’une hématose indépendante (début de la
respiration).
Ce démarrage du système cardio-vasculaire avec mise en place progressive des vaisseaux va
de pair avec le phénomène d’hématopoïèse : ce sont les mêmes cellules qui au départ donnent
naissance aux vaisseaux et aux cellules sanguines.
24ème semaine (= 6ème mois) : hématopoïèse définitive. Après un certain nombre d'étapes, se
met en place un certain nombre de mécanismes assurant la production des cellules sanguines
définitives.
Entre la 4ème semaine et la naissance, se produit toute un série de phénomènes de maturation
du système cardio-vasculaire: entre autres la maturation du coeur, avec une évolution, une
structuration, une organogénèse (qui est d'ailleurs associée à celle des gros vaisseaux)
complexe et longue, ce qui explique le fait que l'on trouve un plus grand pourcentage de
malformations de celui-ci.
Naissance: fermeture du canal artériel et du foramen ovale - étape critique et fondamentale
dans l'évolution du système cardio-vasculaire.
Tout au long de la vie embryonnaire sont mis en place 3 shunts physiologiques. Ces 3 shunts
(canal d
’
arantius, canal artériel et foramen oval) sont fermés à la naissance et permettent la
circulation de type adulte.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%