II. Etude expérimentale d`une estérification.

Les réactions d’estérification et d’hydrolyse
I. Des exemples de substances odorantes : les esters.
Les esters sont des composés odorants présents en abondance dans les fruits mûrs (ananas, poire,
banane..) et qui entrent souvent dans la composition des huiles essentielles (Lavande…).
Ils sont utilisés dans la fabrication des parfums.
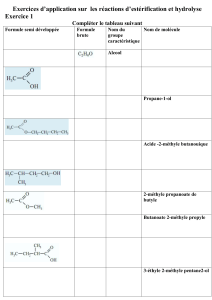
1.1.Formule générale :
R représente ….
R’ représente ….
Le groupe caractéristique des esters est :
1.2.Préparation d’un ester : l’estérification
L’ester résulte de la réaction d’un alcool R-OH et d’un acide carboxylique R-COOH
Bilan : Acide + alcool = ester + eau
Ecriture générale : + = +
Exemple : CH3—C = O + CH3—OH =
|
OH
1.3. Nomenclature des esters :
Partie provenant de l’acide carboxylique
Partie provenant de l’alcool
Nomenclature :
Le nom de l’ester s’obtient en remplaçant la terminaison « -oïque » de l’acide carboxylique qui
correspond par « -oate » de (ou d’) suivie du nom du groupe correspondant à la chaîne carbonée de
l’alcool (terminaison en « -yle » comme tous les groupes).
Exemple :
CH3 - CH2 - C – O – CH2 - CH3 est le propanoate d’éthyle.
||
O
CH3 – CH2 – CH2 – CH2 – O – C – H est le
||
O
II. Réaction d’hydrolyse.
La réaction d’hydrolyse est la réaction inverse de l’estérification, elle consiste à couper la molécule
d’ester avec l’eau pour donner l’acide carboxylique et l’alcool qui correspondent.
Ester + eau = acide carboxylique + alcool
R-C
O
O-R’
R-C
O
O-R’

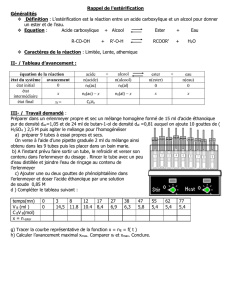
I. Objectifs.
Déterminer expérimentalement les principales caractéristiques des transformations mettant en jeu les réactions
d'estérification.
II. Etude expérimentale d’une estérification.
Différentes réactions d’estérification seront menées simultanément. Le volume du mélange réactionnel est le
même pour toutes les expériences VT = 11,5 mL. L’avancement de la réaction et le taux d’avancement seront
étudiés par titrage à 0 h*, 0,5 h et 1,0 h (*le titrage est réalisé le plus rapidement possible après le
mélange.)
Composition des différents mélanges :
Numéro
Mélanges initiaux
1
Éthanol V = 5,8 mL
Acide éthanoïque V = 5,7 mL
(réalisé à température ambiante)
2
Éthanol V = 5,8 mL
Acide éthanoïque V = 5,7 mL
T° = 80°C
3
Éthanol V = 5,8 mL
Acide éthanoïque V = 5,7 mL
Acide sulfurique concentré : (0,1 mL)
5 gouttes environ T° = 80°C
4
Éthanol V = 6,8 mL
Acide éthanoïque V = 4,7 mL
Acide sulfurique concentré : (0,1 mL)
5 gouttes environ T° = 80°C
5
Éthanol V = 7,8 mL
Acide éthanoïque V = 3,7 mL
Acide sulfurique concentré : (0,1 mL)
5 gouttes environ T° = 80°C
6
Éthanol V = 8,8 mL
Acide éthanoïque V = 2,7 mL
Acide sulfurique concentré : (0,1 mL)
5 gouttes environ T° = 80°C
1. Question préliminaire.
Écrire l’équation de la réaction mise en jeu dans les différents mélanges sachant que l'acide
sulfurique n'est jamais consommé. Nommer l’ester formé.
2. Manipulation
Chaque binôme réalise un seul mélangé qui lui est attribué. (Mon groupe : …………………)
LUNETTES ET BLOUSE OBLIGATOIRE. Préparer la burette graduée de 25 mL avec la solution de
soude de concentration cB = 2,00 mol.L-1 et placer l’agitateur magnétique sous la burette.
Préparer également, un Erlenmeyer de 50 mL contenant quelques gouttes de phénolphtaléïne :
l’indicateur coloré.
Réaliser le mélange correspondant à votre groupe dans un tube à essais. Agiter efficacement.
IMMEDIATEMENT APRES, déclencher le chronomètre et à l’aide d’un dispositif approprié,
prélever 2,0 mL de mélange et les verser dans l’Erlenmeyer. Placer cet Erlenmeyer dans un bain de
glace.
Placer le plus rapidement possible, le tube à essais surmonté d’un tube à reflux droit dans le bain
marie (sauf pour le groupe 1) et effectuer le dosage de l’échantillon prélevé.
Noter avec précision le volume de soude versé à l’équivalence.
Faire à nouveau un dosage à 0,5 h puis 1 h. Agiter efficacement le tube à essais avant chaque
prélèvement et rincer correctement l’Erlenmeyer entre chaque titrage.
3. Exploitation
Calculer les quantités de matière de réactifs contenus dans votre mélange initial. En déduire
l’avancement maximal de votre mélange.
Dans les mélanges coexistent l'acide sulfurique et l'acide éthanoïque. Ces deux acides réagissent
intégralement avec l'hydroxyde de sodium. On appelle nA(i) la quantité totale d’acide présent dans
l’échantillon à t = 0, nA(t) la quantité totale d’acide présent dans l’échantillon dosé à la date t, VB(0) le volume
de soude versé lors du dosage à la date t = 0 et VB(t) le volume de soude versé lors du dosage à la date t.
Indiquer le lien entre nA(t), cB et VB(t) en exploitant les titrages.
T.P. de chimie N°11 : Contrôle des réactions d’estérification.

Montrer que la quantité d’acide éthanoïque consommé dans 2 mL du mélange à la date t noté nAE(t)
est égal à : nAE(t)= xf = cB . ( VB(0) - VB(t) )
Cette quantité doit être ramenée au volume initial du mélange en multipliant par un facteur 11,5/2.
Calculer alors l’avancement final de votre réaction et en déduire le taux d’avancement.
Préciser quels mélanges il convient d’analyser pour vérifier que :
– les transformations associées à ces réactions sont lentes ;
– les transformations associées à ces réactions ne sont pas totales ;
– les transformations sont plus rapides en présence d'acide sulfurique concentré ;
– la présence d'acide sulfurique ne modifie pas l'état d'équilibre final du système ;
– l'état d'équilibre peut être modifié en utilisant un excès de l'un des réactifs.
Exprimer la constante d’équilibre de votre réaction et calculer sa valeur à partir de vos résultats.
Données :
Espèce chimique
Masse molaire
g.mol-1
Densité par rapport
à l’eau à 20°C
éb ( °C )
Concentration
molaire (mol.L-1)
Acide éthanoïque
60
1,05
118
Ethanol
46
0,79
78
Ethanoate d’éthyle
88
0,90
78
Eau
18
1,00
100
pKA du couple CH3CO2H(aq)/ CH3CO2-(aq) : pKA = 4,7.
Tempé
rature
Numér
o
Mélanges initiaux
Volume de
soude
(mL)
Taux
d'avanceme
nt
1
Éthanol
…….. mol
Acide éthanoïque
…….. mol
0 h
0
0,5 h
1 h
2
Éthanol
…….. mol
Acide éthanoïque
…….. mol
0 h
0
0,5 h
1 h
3
Éthanol
…….. mol
Acide éthanoïque
…….. mol
Acide sulfurique
concentré
1 mL environ
0 h
0
0,5 h
1 h
4
Éthanol
…….. mol
Acide éthanoïque
…….. mol
Acide sulfurique
concentré
1 mL environ
0 h
0
0,5 h
1 h
5
Éthanol
…….. mol
Acide éthanoïque
…….. mol
Acide sulfurique
concentré
1 mL environ
0 h
0
0,5 h
1 h
6
Éthanol
…….. mol
Acide éthanoïque
…….. mol
Acide sulfurique
concentré
1 mL environ
0 h
0
0,5 h
1 h
Compétences expérimentales testées : T.P. chimie N°11
Non acquis
A revoir
Bonne maîtrise
Ecrire l’équation d’une estérification
Mettre en œuvre un titrage colorimétrique précis.
Comprendre un suivi temporel par titrages successifs
Comparer des taux d’avancement pour caractériser une réaction

matériel
Au bureau
acide éthanoïque pur + bécher
alcool absolu + bécher
acide sulfurique concentré (18 M) avec compte-goutte
solution de soude de concentration 2,00 mol.L-1 : 2,0 L
3 bains-marie (fond de classe) avec support pour accueillir les gros tubes à essais
Glaçons (en réserve dans le frigo : assez grosse quantité)
Par binôme :
lunettes
cristallisoir (pas trop grand)
burette graduée de 25 mL
agitateur magnétique + turbulent
un gros tube à essai
1 tube à reflux droit qui s’adapte sur le tube à essais
2 béchers dont 1 de 50 mL
Un Erlenmeyer
phénolphtaléïne
pipette graduée de 10 mL
Pipette jaugée (ou graduée) de 2mL
chronomètre
1
/
4
100%