Catabolisme glucidique

Catabolisme glucidique
Introduction
Le métabolisme est l'ensemble des réactions chimiques d'une cellule. On va avoir une
succession ordonnée de réaction chimiques qui peuvent être soit une voie métabolique,
soit un cycle métabolique. Ce métabolisme n'est possible que par la présence de
catalyseurs ou enzymes et les voies métaboliques vont se diviser en 3 catégories :
catabolique, anabolique et amphibolique.
Le but de ce catabolisme est de transformer les aliments en énergie cellulaire.
L'ensemble des réactions de biosynthèse = anabolisme (elle nécessite de l'énergie), elles
sont endothermiques.
L'ensemble des réaction de dégradation = catabolisme (transforme les aliments en
énergie cellulaire, elles font intervenir des processus d'oxydations). Elles sont
exothermiques.
Il y a un équilibre entre les vois de catabolisme et d'anabolisme, équilibre entre les apport
et les dépenses : l'homéostasie résulte d'un équilibre entre les dépenses et les apports
énergétiques.
Les voies amphiboliques se situent au carrefour du métabolisme, et servent de lien entre
l'anabolisme et le catabolisme.
On a 3 grands métabolismes :
- glucidique
- lipidique
- azoté
Les deux premières voies (glucidique et lipidique) sont orientés vers la fourniture d'énergie
aboutissant à l'acétyl CoA. Les lipides alimentaires sont la source dʼacide gras a longue
chaine qui peuvent etre oxydé en acétyl CoA cʼest ce quʼon appelle la béta oxydation ou
alors ils peuvent etre estérifié avec le glycérol pour former les triacideglycérol qui sont le
principales réserves énergétiques de lʼorganisme.

Le métabolisme protéique (métabolisme azoté) est dirigé vers la biosynthèse, mais dans
certaines circonstances, il permet parfois la production d'énergie notamment en cas de
jeun.
Le catabolisme glucidique
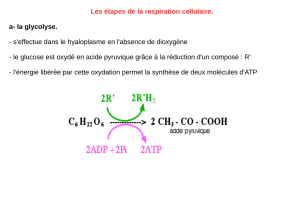
- La glycolyse : désigne la voie de dégradation du glucose en acide pyruvique (voie
aérobie) ou la dégradation du glucose en acide lactique (voie anaérobie).
On a un cas particulier, celui du métabolisme du fructose et du galactose, qui vont
rejoindre la voie de la glycolyse.
- La glycogénolyse : est la dégradation du glycogène en glucose 6 phosphate, puis en
glucose.
On trouve aussi la voie des pentose phosphate dans le catabolisme glucidique, elle a pour
but d'apporter des équivalents réducteurs sous forme de NADPH pour la synthèse des
acides gras et elle permet aussi la synthèse de riboses.
L'anabolisme glucidique
- La néoglucogenèse : formation de glucose à partir de précurseurs non glucidiques.
- La glycogénogenèse : formation de glycogène a partie d'oses.
Rappel de thermodynamique
Les organismes vivants utilisent de l'énergie chimique des différents combustibles pour la
synthèse de leurs propres molécules. On dégrade les glucides, les lipides et les acides
aminés (les nutriments) sous forme finale de CO2, d'eau et d'énergie => c'est une
oxydation.
Exemple du glucose
La variation d'énergie libre, le ΔG, permet de prédire le sens de la réaction. si la réaction
est à l'équilibre, ΔG = 0
A + B = C + D, on peut calculer la variation du ΔG (variation d'énergie libre réelle,
physiologique) grâce à la relation :
ΔG = ΔG0° + RT ln [C][D]/[A][B]
R : constante des gaz parfaits
T : degrés K
ΔG° : variation d'énergie libre dans les conditions standard.
En chimie, en condition standard on est à 1 molaire et pH = 0 et T° de 25°C (et à la
pression de 1 atm pour les conditions standards)
En biochimie, en condition standard on est à :
#PH = 7, ou [H+] = 10^-7 mol/L
#[H2O] = 55 mol/L
#[Mg2+] = 10-3 mol/L
#T° = 37°C
A l'équilibre la variation d'énergie est nulle on a donc : ΔG°' = - RT ln K'c
=> On va pouvoir déterminer le sens de la réaction en fonction de K'c et de ΔG°'
- Si K'c = 1, delta G°' = 0 => État d'équilibre.
- Si K'c > 1 ΔG°' est négatif => on va dans le sens allé.
- Si K'c < 1 ΔG°' est positif => on va dans le sens du retour.
(Delta G'° c'est indépendamment des conditions physiologiques).

Ce qui va donner le sens de réaction c'est le Delta G (et non Delta G') qui est la variation
d'énergie physiologique réelle car nous sommes jamais dans les conditions standards
Delta G0' (Delta G varie en fonction des conditions physiologiques).
Exemple de la transformation du glucose 6 phosphate en fructose 6 phosphate :
Cette réaction est catalysée.
Le calcul ne correspond pas tout à fait à ce qui ce passe en réalité car en réalité du fait
d'un flux métabolique le fructose 6 phosphate va disparaître au fur et à mesure et le
rapport est pas de ½ mais de 1/3. À lʼéquilibre Kʼc = 1/2
On tombe sur une valeur négative.
Notion de couplage pour des réactions endergonique
L'additivité des variations d'énergie libre va permettre à une réaction dite endergonique
d'être entrainer par une réaction dite exergonique. Phénomène à la base de tout le
fonctionnement métabolique car la plupart des réactions sont couplées. C'est l'ATP qui est
un agent de couplage énergétique dans la biosynthèse.
Endergonique = Delta G > 0 / Exegonique = Delta G < 0. Stratégie utilisée pour la
synthèse de cellules vivantes (le couplage)
La synthèse du glc-6-P : Lʼadditivité des variations dʼénergie cʼest le phénomène qui est a
la base de tout le fonctionnement des voies métaboliques.

- Lorsque ΔG est fortement négatif, la réaction est irréversible.
- Lorsque ΔG est fortement positif, la réaction est irréversible.
- Lorsque ΔG est proche de 0, on est a l'équilibre.
Les énergies libres standard de l'hydrolyse de quelques composés phosphorylés (ΔG°' en
condition standards biochimiques)
- l'énergie de l'hydrolyse de l'ATP en ADP + PI = -30,5 KJ/mol ou -7,3 kcal/mol
- l'énergie de l'hydrolyse de l'AMP en adénosine + PI = -14,2 KJ/mol ou -3,3 kcal/mol
=> Au dessus de 30 KJ/mol on considère que on a un composé très riche en énergie.

I- Digestion et absorption des glucides
1- La digestion des glucides
#
Les glucides sont présents dans les aliments. Ce sont la plupart du temps des
polysaccharides (amidon et glycogène) ou des disaccharides (saccharose (sucre de table)
et lactose).
Mais seulement les monosaccharides (oses simples) sont capables de traverser les
membranes cellulaires. Donc par ce principe la digestion nécessite une hydrolyse par des
enzymes extra-cellulaire pour former des mono saccharides capables de traverser les
membranes et notamment la barrière intestinale (cellules de lʼépithélium intestinal).
Hydrolyse de l'amidon et du glycogène :
L'alpha amylase est sécrété par les glandes salivaires et le pancréas, cette enzyme
permet l'hydrolyse de l'amidon et du glycogène en :
- maltose
- maltotrioses
- dextrines (chaine ramifiées avec ramification alpha 1-6 )
- isomaltoses (chaines ramifiées avec ramification alpha 1-6)
La digestion se poursuit ensuite au niveau de l'estomac grâce à l'enzyme alpha 1-6
glucosidase intestinale.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%