changement de la structure trophique des communautes de

216
10. CHANGEMENT DE LA STRUCTURE TROPHIQUE DES
COMMUNAUTS DE POISSONS DEMERSAUX
Le chapitre 7 met en avant l’impact de la pêche pour expliquer la situation inquiétante de certains
stocks d’espèces démersales. Il serait sans doute exagéré de dire que l’exploitation explique à elle
seule l’état de la ressource. En effet, nous avons vu au travers du chapitre 8, que les conditions
environnementales jouent très certainement un rôle non négligeable sur l’évolution de la biomasse.
Pour le moment, il est difficile de quantifier cet impact et d’en tenir compte pour la gestion. Au chapitre
précédent, nous avons tenté de comparer l’évolution de l’abondance d’une communauté à celle de
certaines espèces structurant cette dernière. Il ressort que la communauté joue un rôle tampon et que
les variations d’abondance sont plus atténuées à ce niveau. Au travers de ces deux analyses, on s’est
intéressé à des interactions que l’on peut qualifier de simples et directes.
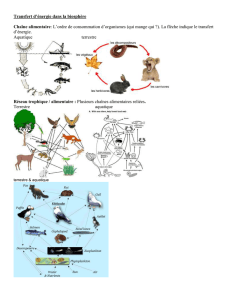
Dans ce chapitre, nous essayons d’observer ce qui se passe à une plus grande échelle en intégrant
les informations disponibles sur l’écosystème. On analyse les évolutions d’abondance qui s’y
s’opèrent en considérant l’ensemble des espèces démersales regroupées par classe trophique et les
évolutions du niveau trophique moyen. L’objectif de cette approche est de révéler des mécanismes
expliquant les dynamiques observées au sein de l’écosystème. Ce travail a donné lieu à la rédaction
d’une publication dans le journal Aquating Living Ressources
1
. Nous reprenons ici la structure et les
résultats de cette publication.
10.1. Introduction
De nombreux travaux montrent que la première conséquence de l’exploitation d’espèces ciblées par la
pêche est la diminution de leurs biomasses (Millner et Whiting, 1996 ; Pope et Macer, 1996 ; Haedrich
et Barnes, 1997). Les évaluations de stocks conduites en Afrique de l’Ouest mènent à la même
conclusion (Longhurst 1969 ; Domain, 1980). Actuellement, les principales espèces démersales
recherchées par les pêcheries en Afrique de l’ouest sont surexploitées (chapitre 7), et il semblerait
que les espèces de haut niveau trophique soient plus particulièrement concernées (Laurans et al.
2002). Il se pourrait que les traits d’histoire de vie de ces espèces les rendent plus sensibles à
l’exploitation (Jennings et al., 1999).
L’exploitation au Sénégal et en Guinée a commencé au début des années 1950, mais elle s’est
réellement développée au cours des trois dernières décennies. Les captures d’espèces démersales
ont augmenté de 10 à 62 000 tonnes en Guinée entre 1985 et 2000 (Figure 4.10) et de 20 à 130 000
tonnes au Sénégal entre 1971 et 1999 (Figure 4.7). Les écosystèmes marins de ces deux pays, au vu
de l’exploitation qu’ils subissent, paraissent être de bonnes zones tests pour rechercher des
1
Laurans, M., Gascuel, D., Chassot, E., Thiam, D., 2004. Changes in the trophic structure of fish demersal communities in West
Africa in the three last decades. Aquat. Living Resour. 17, 163-173.

217
modifications dans la structure trophique que l’on pourrait associer à l’augmentation de la pression de
pêche. L’objectif de ce travail est d’estimer l’impact de la pression de pêche sur la communauté de
poissons démersaux en Guinée et au Sénégal. Deux aspects sont abordés. En premier lieu, les
possibles changements de la structure trophique de la communauté des poissons démersaux sont
considérés en comparant la dynamique du spectre trophique de la biomasse et des captures à
différentes périodes. En second lieu, la tendance du niveau trophique moyen des captures et de
l’abondance est calculée et comparée dans chaque écosystème. Afin de replacer de ce travail dans
un contexte plus large, nous comparons ces résultats avec ceux obtenus dans des écosystèmes plus
connus dans l’Atlantique Nord.
10.2. Matériels et Méthodes
Les spectres trophiques et le niveau trophique moyen sont estimés à partir de deux sources de
données au Sénégal et en Guinée, à savoir les campagnes scientifiques sur les poissons démersaux
et les données commerciales de captures.
10.2.1. Données des campagnes scientifiques
• Sénégal
Les données de campagnes scientifiques sont les mêmes que celle du chapitre 9. Pour le présent
travail on utilise en plus les données de campagnes effectuées en décembre 1971 et celles de 1972
et 1974 (Tableau 3.2). On ne considère que les traits de chalut effectués entre 5 et 100 mètres de
fond sur le plateau continental (Figure 9.1), au-delà ils sont rares. Au total, dix huit campagnes sont
utilisées. Des campagnes ont été réalisées entre 1974 et 1986, mais les données ne sont pas
disponibles à l’heure actuelle.
• Guinée
Les objectifs des campagnes conduites en Guinée sont les mêmes qu’au Sénégal et l’on utilise
l’ensemble des campagnes conduites en Guinée (Tableau 3.2). La zone couverte par ces campagnes
est principalement la partie du plateau d’une profondeur inférieure à 30 mètres entre 9 et 11°N, sauf
pour trois campagnes que l’on a exclues de l’analyse.
Comme dans la chapitre précédent, les captures sont considérées comme un indice d’abondance de
la biomasse des communautés de poissons démersaux présents dans l’écosystème.
10.2.2. Captures commerciales de poissons démersaux.
Pour les deux pays, les données de captures proviennent des centres de recherches nationaux, soit le
CRODT au Sénégal et le CNSHB en Guinée. On reprend ici les donnée telles qu’elles sont
présentées dans le chapitre 4. Il s’agit donc des captures de l’ensemble des espèces démersales sur
la période comprise entre 1981 et 1999 au Sénégal et sur la période 1995 et 1998 en Guinée.

218
10.2.3. Le niveau trophique et le spectre trophique
Le niveau trophique moyen de chaque espèce provient de la base de données FishBase version 2000
(Froese et Pauly, 2000). Ces niveaux trophiques sont estimés à partir de contenus stomacaux. Tous
les niveaux trophiques considérés dans ce travail sont donnés en annexe 11. Dans une version plus
récente de Fishbase (2004), certains niveaux trophiques sont revus. Une analyse exploratoire partielle
montre que les résultats présentés ci-après ne sont pas modifiés.
La construction d’un spectre trophique est proposée par Gascuel (sous presse). A partir des
campagnes scientifiques, le spectre trophique de biomasse (STB) décrit la distribution de la biomasse
de la communauté démersale en fonction de classes trophiques. La biomasse est mesurée par un
indice d’abondance correspondant à la capture du chalut en 30 minutes. De la même manière, le
spectre trophique des captures (STC), établi à partir des captures commerciales, précise à quel
niveau de la chaîne trophique elles sont faites. Toutes les espèces, pour lesquelles un niveau
trophique est connu, sont prises en compte dans la construction d’un spectre trophique. Elles
représentent entre 80 et 90% de la biomasse ou des captures totales. A partir des campagnes, pas
moins de 177 espèces sont prises en compte en Guinée et 153 au Sénégal. Pour les captures
commerciales, 58 et 129 espèces sont considérées en Guinée et au Sénégal. Un STB est construit
pour un trait de chalut ou pour une agrégation de traits.
Les variables retenues permettent de caractériser un STB, à savoir la date (année, mois, saison), la
bathymétrie et la position géographique. Les STC sont construits à partir des données de captures
annuelles. Pour un STB ou un STC, on somme les biomasses ou les captures des espèces
appartenant à la même classe trophique. Chaque classe trophique est définie par un pas de 0,1 entre
les niveaux trophiques 2 et 4.5. La valeur du niveau trophique de chaque espèce permet son
positionnement dans une classe trophique précise. Un spectre trophique lissé est calculé ; pour
chaque classe trophique, une valeur est estimée comme étant la moyenne mobile de trois classes
trophiques (celle considérée, la précédente et la suivante). Ce lissage est une manière de tenir
compte de la variabilité du niveau trophique inhérente à la variation de l’alimentation (Davenport et
Bax, 2002) et à l’incertitude de son estimation (Pinnegar et al., 2002).
10.2.4. Comparaison des spectres trophiques
Les modèles linéaires généralisés (chapitre 5.1) sont utilisés pour analyser les changements de
structure des STB. Les biomasses par classe trophique dans chaque groupe de trait de chalut
représentent les individus statistiques. Les classes trophiques, l’année, la saison, les classes de
latitude et de bathymétrie sont les variables descriptives. Les STB sont obtenus à partir de
l’agrégation de traits par strate car cette approche permet de lisser la variabilité entre les traits
caractérisés par la même combinaison de facteurs. Des classes d’année sont créées afin de prendre
en compte le fait que les données n’existent pas pour certaines années et que l’on recherche les
possibles variations temporelles des STB (Tableau 10.1).

219
L’analyse exploratoire des jeux de données nous a poussés à choisir un modèle linéaire généralisé
avec un lien identité, soit le cas particulier où le GLM est un modèle linéaire (LM). Le modèle linéaire
suivant a été testé :
ε
µ
+
+
+
+
+
+
=
(1)
Où B est le logarithme de la biomasse par classe trophique,
µ
est l’intercept, TC est la classe
trophique (entre 2.1 et 4.5), Y est la classe année, L est la classe de latitude, Ba est la classe de
Bathymétrie, S est la saison et
ε
est le résidu (Tableau 10.2).
Les effets croisés sont testés entre les variables, en particulier entre TC et Y et TC et L. Ces effets
d’interaction sont recherchés afin de voir si la distribution de la biomasse par classe trophique évolue
au cours du temps ou en fonction de la position géographique. L’analyse de déviance permet de
sélectionner les variables et les effets croisés ayant un rôle significatif dans l’explication de la réponse.
Le test de déviance et l’analyse des résidus permettent de juger de l’adéquation du modèle.
Les variations des STC sont explorées de la même manière, seulement deux variables explicatives
sont prises en compte, la classe trophique et la classe année, car aucune autre information n’est ici
disponible.
Tableau 10.1 : Classe d’année utilisée dans le modèle linéaire (LM).
Tableau 10.2 : Classe des variables utilisées dans le modèle linéaire (LM). long=longitude; lat=latitude
!"
"!"
#!
!$%
"!&%
!'()*
"!#(+()*
#!,#()*
!
"!#
!$%
"!&%
!'
"!'",
#!,"
!-."(+
"!-."#(#

220
10.2.5. Le niveau trophique moyen
Le niveau trophique moyen des poissons démersaux est calculé chaque année à partir des
campagnes de la manière suivante :
==
=
/
(2)
Où Y
ik
est la capture de l’espèce i pour l’année ou la campagne k et TL
i
le niveau trophique de cette
espèce. Le niveau trophique moyen des captures commerciales de poissons démersaux est estimé en
appliquant la même formule. Afin de vérifier que les tendances sur le long terme du niveau trophique
moyen de la biomasse et des captures sont significatives, on applique le test non paramétrique de
Mann-Kendall (Scherrer, 1984), qui a l’avantage de n’exiger aucune distribution particulière des
données. Une tendance est jugée significative lorsque p<0,05. Lorsque la tendance est significative, la
pente est estimée selon la procédure développée par Sen (1968). De plus, à partir des données de
capture on calcule un FIB (Fishing in Balance) (Pauly et al., 2000). Le FIB pose comme postulat
qu’une diminution du niveau trophique moyen des captures de 1 doit entraîner une multiplication des
captures par 10. Un écosystème à l’équilibre doit avoir un FIB constant.
×
×
=
−
−
(3)
10.3. Résultats
10.3.1. Les spectres trophiques
Sénégal
Le modèle linéaire développé à partir des campagnes explique 84.5 % de la déviance de la biomasse
par classe trophique (Tableau 10.3a, Annexe 12). L’interaction significative entre les variables classe
trophique et classe d’années indique que la structure du spectre trophique de biomasse a évolué
depuis les années 1970 (Figure 10.1a). Sur la période considérée, la biomasse dans les classes d’un
haut niveau trophique (4.1-4.5) a diminué, tandis qu’elle a augmenté dans les classes intermédiaires
(3.4-3.6). Au niveau spécifique ce changement correspond une abondance plus élevée d’espèces de
niveau trophique intermédiaire comme Pomadasys incisus et plus faible pour des espèces de niveau
trophique élevé comme Epinephelus aeneus.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%