La lignée germinale dans la différenciation ovarienne

Solange Magre
Université Paris Diderot,
Sorbonne Paris Cité
Biologie Fonctionnelle
et Adaptative
EAC CNRS 4413
Physiologie de l’Axe
Gonadotrope
4 rue MA Lagroua
Weill-Hallé
75205 Paris cedex 13,
France
E-mail : solange.magre@
univ-paris-diderot.fr
Mots-clés :
ovaire,
folliculogenèse,
apoptose ovocytaire.
37
Médecine Clinique endocrinologie & diabète • n° 52, Mai-Juin 2011
Synthèse
La lignée germinale dans
la différenciation ovarienne :
un équilibre subtil entre présence
nécessaire et disparition
programmée
hez la femme comme pour l’ensemble
des femelles de mammifères, la fertilité
est strictement dépendante de la taille du
stock d’ovocytes, établi dès la période fœtale,
mais aussi du bon déroulement de la folli-
culogenèse tout au long de la vie reproduc-
tive. En l’absence de cellules souches permet-
tant la régénération du stock d’ovocytes, toute
atteinte d’ordre génétique ou environnemen-
tale (facteurs nutritionnels, xénobiotiques ou
abiotiques), entraînant une perturbation de ces
différentes étapes, aura une répercussion directe
sur la fertilité pouvant aller d’une insuffisance
ovarienne précoce à une stérilité immédiate.
Toutefois, physiologiquement, tout au long
de la vie reproductive de la femelle, on assiste
à une déperdition continue des cellules de la
lignée germinale que ce soit durant la vie fœtale,
avant ou après leur entrée en méiose, ou dès
leur incorporation dans le follicule, au cours
du phénomène d’atrésie folliculaire. Ainsi, les
cellules germinales au nombre de 7 millions à
5 mois de vie intra utérine ne sont plus que 1
million à la naissance et sur les 400 000 folli-
cules présents à la puberté, seuls 400 d’entre
eux atteindront le stade préovulatoire [1, 2].
On estime que plus de 99 % des ovocytes seront
soumis à divers processus de dégénérescence [3].
La différenciation, la maturation et la fonc-
tion ovarienne dépendent d’un équilibre précis
entre présence et disparition des cellules germi-
nales et cela à toutes les étapes du développe-
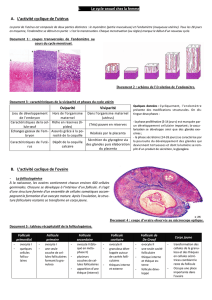
ment ovarien (Figure 1).
Différenciation ovarienne et
histogenèse folliculaire
Les gonades se différencient à la surface du
mésonéphros, rein embryonnaire (disparais-
sant à la fin du deuxième mois). Tout d’abord
identiques dans les deux sexes, elles forment
un blastème cellulaire qui se distingue des terri-
toires avoisinants par la colonisation des cellules
germinales primordiales (CGP) provenant de
territoires extra embryonnaires (la base de l’al-
lantoïde), via le mésentère dorsal. La migration
des CGP dans le territoire gonadique se produit
dans la 4ème semaine chez le fœtus humain [4].
Parmi les différents facteurs impliqués dans
la migration et la multiplication des PGC, citons
le facteur Kit-ligand (appelé aussi Steel factor ou
Stem cell factor) exprimé par les cellules soma-
tiques présentes le long des voies de migration
et son récepteur à tyrosine kinase c-Kit, exprimé
par les CGP. Les gènes codant ces deux protéines
Aspect histologique
de l’ovaire
Blastème
1 2 3
5
4
Cordons ovigères Follicules Corps jaunes
Indiérenciées Pregranulosa
Ovogonies Ovocytes
Granulosa
du cumulus
Lutéales
Murales
Diérenciation du
lignage Granulosa
Diérenciation du
lignage Germinal
Figure 1. Principales étapes de la différenciation ovarienne et contribution du lignage germinal à
la différenciation du lignage granulosa. La présence des ovogonies n’est pas nécessaire à la différen-
ciation des cordons ovigères (étape 1). Les ovocytes sont indispensables à la formation des follicules
(étape 2) et à l’établissement du gradient de différenciation des cellules de la granulosa : cellules du
cumulus vs cellules murales (étapes 3 et 4). A la suite de l’expulsion de l’ovocyte lors de l’ovulation, les
cellules de la granulosa se différencient en cellules lutéales (étape 5) (modifié d’après [4]).
SynyhèseMagre.indd 37 11/07/11 18:22

38 Médecine Clinique endocrinologie & diabète • n° 52, Mai-Juin 2011
Synthèse
sont situés respectivement dans les
loci Sl et W dont les mutations ont été
décrites au milieu de siècle dernier chez
les souris Steel et White spotting, stériles
à l’état homozygote [5, 6].
Après leur migration dans les crêtes
génitales, les cellules germinales deve-
nues ovogonies chez les femelles et sper-
matogonies chez les mâles présentent
une forte activité mitotique. C’est au
cours de cette période que les cellules
germinales atteignent leur nombre
maximum chez la femelle.
Le premier événement caractéris-
tique de la différenciation ovarienne est
l’entrée en prophase de première divi-
sion méiotique des ovogonies, appelées
dès lors ovocytes (rappelons que l’en-
trée en méiose se produit à la puberté
chez les mâles). Elle débute dès la
12ème semaine. Les ovocytes progres-
sent à travers les stades de la prophase
méiotique : leptotène, zygotène, pachy-
tène, jusqu’au stade diplotène dans
lequel ils vont rester bloqués (noyau
dyctié) jusqu’à la reprise de la méiose,
déclenchée par le pic préovulatoire de
LH (hormone lutéinisante). L’entrée en
méiose des ovogonies correspond à une
phase intense d’apoptose, en particulier
au stade pachytène, faisant chuter d’un
tiers le nombre de cellules germinales.
Au cours du développement fœtal de
l’ovaire les ovogonies puis les ovocytes
sont intégrés dans des structures épithé-
liales qui s’organisent au sein du blas-
tème. Ces structures délimitées par
une membrane basale continue qui les
isolent du tissu mésenchymateux sont
appelés cordons ovariens ou cordons
ovigères. Outre les cellules germinales,
les cordons ovigères sont formés par des
cellules épithéliales qui deviendront les
cellules folliculaires, les cellules de la
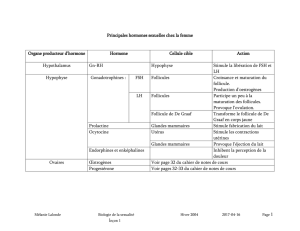
prégranulosa (Figures 2 et 3).
Il est intéressant de noter que cette
étape de morphogenèse épithéliale peut
se faire indépendamment de la présence
des cellules germinales (Figure 1). Si
celles ci sont absentes soit par exemple
chez les souris mutantes steel ou white
spotting ou détruites par un traitement
antimitotique (busulphan) ou à la suite
d’une irradiation, les structures épithé-
liales stériles sont présentes [7, 8]. Elles
vont toutefois progressivement dispa-
Membrane
basale
Cellule
prégranulosa
Ovocyte
cellule
mésenchymateuse
Ovocyte
en
apoptose
invasion des
cellules
mésenchymateuses
Figure 2. Schéma récapitulatif des étapes nécessaires à la formation des follicules. (modifié d’après [8])
(I) : cordon ovigère ; (II) et (III) : apoptose ovocytaire et fragmentation du cordon ovigère.
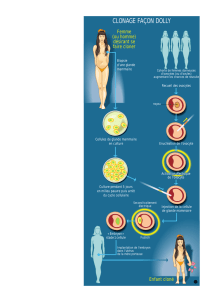
Figure 3. Aspect histologique de la différenciation ovarienne (chez la ratte à 1 jour postnatal).
La morphogenèse des follicules s’établit selon un gradient du centre vers la périphérie de l’ovaire. Les folli-
cules (primordial, primaire et secondaire) sont visibles au centre de l’ovaire. A la périphérie, on observe
les différentes étapes de la morphogenèse folliculaire schématisées dans la figure 2. (I) : cordon ovigère ;
(II) et (III) : apoptose ovocytaire et fragmentation du cordon ovigère.
(o : ovocyte ; pg : cellule prégranulosa ; m : cellule mésenchymateuse)
raître et l’ovaire régresser pour devenir
une bandelette fibreuse ou streak gonad.
En effet, l’étape suivante de la diffé-
renciation ovarienne, la formation des
follicules ou histogénèse follicu-
laire, est strictement dépendante de
la présence des ovocytes (Figure 1), en
leur absence, les follicules ne se diffé-
rencient pas. Toutefois, d’une manière
paradoxale, c’est au cours de cette phase
SynyhèseMagre.indd 38 11/07/11 18:22

Médecine Clinique endocrinologie & diabète • n° 52, Mai-Juin 2011 39
que l’on assiste une nouvelle fois à une
vague d’apoptose massive des ovocytes.
En conséquence le ratio entre le nombre
de cellules de la lignée germinale et le
nombre de cellules de la lignée granu-
losa se modifie en faveur de ces dernières
(Figure 2). Chaque ovocyte survivant est
entouré progressivement par les cellules
épithéliales de la prégranulosa. Il se
forme ainsi un follicule délimité par une
membrane basale continue le séparant
du tissu mésenchymateux qui s’insinue
entre les follicules en formation, ce qui
a pour conséquence la fragmentation et
donc la disparition du cordon ovigère
(Figures 2 et 3).
L’histogenèse folliculaire débute à
partir de la 16ème semaine chez le fœtus
humain. Les follicules qui se sont formés
au cours de cette étape sont des folli-
cules primordiaux caractérisés par
une assise de cellules de la granulosa
aplaties (ou squameuses). La grande
majorité d’entre eux va rester à l’état
quiescent et constituer la réserve folli-
culaire qui assurera l’intégralité de la vie
reproductive de la femelle.
Folliculogenèse
A partir de la puberté, la matura-
tion ovocytaire se fait en étroite rela-
tion avec la folliculogenèse, processus
regroupant les étapes de sélection et de
croissance folliculaire depuis le stade
follicule primordial jusqu’au stade
préovulatoire. La folliculogenèse dont
la durée chez la femme est estimée à
200 jours [9] est classiquement subdi-
visée en deux étapes, la folliculogenèse
basale et la folliculogenèse terminale.
Au cours de la folliculogenèse
basale, les follicules initient leur crois-
sance et passent successivement du
stade primordial, au stade primaire
jusqu’au stade petit antral. Cette phase
de croissance n’est pas contrôlée par
les hormones gonadotropes hypophy-
saires mais par des facteurs locaux agis-
sant de manière autocrine ou paracrine.
L’hormone anti-Müllerienne (AMH)
sécrétée par les follicules en croissance
régule la croissance folliculaire en inhi-
bant le recrutement des follicules de la
réserve [10]. Plus directement dans le
cadre des interactions entre ovocyte et
cellules de la granulosa, certains facteurs
de croissance ainsi GDF9 (Growth
Differentiation Factor 9) et BMP15 (Bone
Morphogenetic Protein 15) sécrétés par
l’ovocyte stimulent la croissance du
follicule [11, 12]. Réciproquement le
Kit-ligand sécrété par les cellules de la
granulosa intervient sur la croissance
ovocytaire [13].
La folliculogenèse terminale qui
aboutit à l’ovulation est sous le contrôle
des hormones gonadotropes hypo-
physaires LH et FSH et se déroule en 3
phases successives : recrutement de folli-
cules qui entrent en croissance, sélec-
tion du ou des follicules destiné(s) à
ovuler et dominance, étape au cours de
laquelle les follicules non sélectionnés
vont devenir atrétiques.
A partir de la formation de l’antrum
et au cours de la croissance du folli-
cule antral, les cellules de la granulosa
vont se subdiviser en deux populations :
les cellules du cumulus proches de
l’ovocyte et les cellules murales, à
la périphérie du follicule, proches de
la membrane basale. Ces populations
cellulaires se distinguent par leurs carac-
téristiques morphologiques et fonction-
nelles, ainsi dans le follicule préovula-
toire l’expression des récepteurs de LH
est forte dans les cellules murales et
faible dans les cellules du cumulus ; ces
dernières synthétisant l’acide hyaluro-
nique, glycosaminoglycane participant
à l’expansion du cumulus, nécessaire à
l’ovulation.
Le rôle de l’ovocyte dans le contrôle
de la différenciation des cellules de la
granulosa a été mis en évidence par
des expériences déjà anciennes d’ovo-
cytectomie (chez le lapin ou le rat).
La suppression par microchirurgie de
l’ovocyte d’un follicule préovulatoire
entraîne la lutéinisation des cellules de
la granulosa et la production de proges-
térone normalement observées après
l’ovulation [14] (Figure 1). Cet effet
est réversible si, en culture in vitro, un
ovocyte est ré-associé aux cellules de la
granulosa [15]. Ces approches expéri-
mentales au cours desquelles sont réali-
sées des co-cultures d’ovocytes et de
cellules de la granulosa ont confirmé
l’importance de l’ovocyte dans la diffé-
renciation des cellules de la granulosa
et spécifiquement dans l’établissement
de la différence fonctionnelle entre
cellules du cumulus et cellules murales
[16, 17] (Figure 1). En l’absence d’ovo-
cyte, les cellules de la granulosa, sous le
contrôle des hormones gonadotropes,
suivraient une voie de différenciation
« par défaut » qui les transformerait en
cellules murales puis en cellules lutéales,
alors que la présence de l’ovocyte indui-
rait la différenciation des cellules du
cumulus [18, 19].
L’ensemble des étapes nécessaires à
la différenciation ovarienne et au bon
déroulement de la folliculogenèse fait
appel à un dialogue étroit entre cellules
de la lignée germinale et de la lignée
granulosa, dialogue qui, a cependant
la particularité de s’établir alors que
près de 99 % des cellules de la lignée
germinale disparaissent tout au long
de la vie reproductive. L’identification
de nouveaux facteurs contrôlant les
interactions entre lignage germinal et
lignage granulosa (oocyte-granulosa cell
regulatory loop [18]), aussi bien que ceux
intervenant dans l’établissement du
stock d’ovocytes est un objectif majeur
qui permettra de progresser dans le
domaine des recherches fondamentales
sur la physiologie ovarienne mais aussi
dans la perspective de recherches appli-
quées sur la fertilité humaine.
Références
1. Baker TG, Proc R Soc Lond B 1963 ; 158:417.
2. Gougeon A, Endocr Rev 1996 ; 17:121.
3. Hsueh AJ et al, Endocr Rev 1994 ; 15:707.
4. Guigon CJ & Magre S, Biol Reprod 2006 ;
74:450.
5. Coulombre JL & Russel ES, J Exp Zool 1954 ;
126 : 277
6. McCoshen JA, Am J Obstet Gynecol 1982 ;
142 :83
7. Merchant H, Dev Biol, 1975 ; 44:1.
8. Mazaud Guittot S et al, Biol Reprod 2006 ;
75:749.
9. Monniaux et al, J Reprod Fertil 1997 ; 51:3.
10. Durling AL et al, Endocrinology 1999 ;
140:5789.
11. Di Pasquale E et al, Am J Hum Genet
2004 ; 75:106.
12. Kovanci E et al, Fertil Steril 2007 ; 87:143.
13. Høyer PE et al, Mol Cell Endocrinol 2005 ;
234:1.
14. El-Fouly MA et al, Endocrinology 1970 ;
87:286.
15. Nekola MV et al, Biol Reprod 1971 ; 4:154.
16. Eppig JJ, et al, Biol Reprod 1997 ; 56:976.
17. Salustri A et al, Dev Biol 1990 ; 138:26.
18. Eppig J, Reproduction 2001 ; 122:829–838.
19. Matzuk MM et al, Science 2002 ; 296:2178.
SynyhèseMagre.indd 39 11/07/11 18:22
1
/
3
100%