Les lipides

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 169
Chapitre n° 12 : LES LIPIDES
I) Les acides gras
1)
:
Généralités et définition
Malgré leur importance quantitative comme constituant des lipides complexes, les acides
gras se trouvent en très faible quantité à l’état libre. On connaît et on a isolé plus de 100
acides gras extrait à partir de tissus animaux, végétaux et microorganismes.
:
Les acides gras ne présentent qu'une seule fonction carboxylique (COOH) et ils possèdent
une longue chaîne hydrocarbonée formée de plus de 2 atomes de carbone.
La chaîne peut être saturée ou non. Elle est généralement non ramifiée et parfois cyclique.
Dans la grande majorité des cas, elle est formée d'un nombre pair d'atomes de carbone.
2) Description, nomenclature et symbolique
La nomenclature générale suit les même règles que celle les acides carboxyliques.
:
Le plus simple des acides gras est donc l'acide propanoïque (acide propionique) :
CH3 – CH2 – COOH
L'acide oléique naturel,
qui a pour formule
brute C17H33COOH, est
l'acide Z-octadéca-9-ènoïque :
On peut aussi noter la structure d'un acide gras sous forme de symbole (formule lipide) :
Un acide gras sera donné par : Cn : X∆ trans a
- n est le nombre d’atome de carbone.
- X : est le nombre de doubles liaisons dans la chaîne hydrocarbonée.
- ∆ : signifie qu’il y a une double liaison C == C dans la chaîne.
- a : indique le numéro du premier atome de carbone de la double liaison dans la chaîne.
- On précise si la double liaison correspond à un diastéréoisomère E (trans), s'il s'agit d'un
diastéréoisomère Z (cis), on n'écrit rien.
a) Les acides gras saturés (Cn : 0) :
La formule brute de l’acide gras saturée : CnH2nO2, n est presque exclusivement un
nombre pair de carbone qui va de 4 à 32.
Leur formule lipide est Cn : 0
On peut distinguer :
- Les acides gras saturés à chaîne linéaire :
Ce sont les plus répandus dans la nature par rapport à ceux à chaînes ramifiées.
Exemple : L'acide stéarique C17H35COOH (acide octadécanoïque) a pour formule semi
développée CH3 – (CH2)16 – COOH, pour formule lipide C18 : 0 et pour
représentation topologique :
L'acide palmitique C15H31COOH (acide hexadécanoïque) a pour formule semi
développée CH3 – (CH2)14 – COOH, pour formule lipide C16 : 0 et pour
représentation topologique :

Les lipides
Page 170 Christian BOUVIER
- Les acides gras saturés à chaîne ramifiée :
Pour la plupart il ne possède qu’une seule ramification.
Exemple : L'acide tuberculo stéarique C17H35COOH (acide 10-méthyl-heptadécanoïque)
a pour formule lipide C18 : 0 et a pour représentation topologique :
Cet acide gras se trouve dans les bacilles de coques responsables de la
tuberculose.
b) Les acides gras insaturés éthyléniques :
Les acides gras insaturés éthyléniques sont plus abondants que les acides gras saturés.
Leur formule lipide est Cn : X∆a. On peut distinguer :
- Les acides gras monoéthyléniques :
La double liaison se trouve en position 9 : Cn : 1 ∆9. Formule brute : CnH2n-2O2.
Exemple : L'acide oléique C17H33COOH (acide Z-octadéca-9-ènoïque) a pour formule
lipide C18 : 1∆9 et pour représentation topologique :
L'acide palmitoléique (différent de l'acide palmitique) C15H29COOH (acide Z-
hexadéca-9-ènoïque) a pour formule lipide C16 : 1∆9 et pour représentation
topologique :
- Les acides gras di, tri, polyéthyléniques :
Ces acides gras comportent plusieurs doubles liaisons.
Exemple : L'acide linoléique est indispensable à l’homme qui ne le synthétise pas.
Il a pour formule brute C17H31COOH (acide Z,Z-octadéca-9,12-diènoïque),
pour formule lipide C18 : 2∆9,12 et a pour représentation topologique :
Exemple : L'acide α-linoléique est indispensable à l’homme qui ne le synthétise pas.
Sa formule brute est C17H29COOH (acide Z,Z,Z-octadéc-9,12,15-triènoïque),
sa formule lipide est C18 : 3∆9,12,15 et sa représentation topologique :
Exemple : L'acide oléostéarique C17H29COOH (ac. Z,Z,Z-octadéca-9,11,13-triènoïque), a
pour formule lipide C18 : 3∆9,11,13 et a pour représentation topologique :
c) Autres types d'acides gras :
Il existe d'autres possibilités pour les acides gras :
- Les acides gras cycliques : ces acides gras comportent un cycle.
- Les acides gras porteurs de fonctions diverses : en général, des fonctions oxygénées qui
apparaissent lorsque les acides gras sont au contact de l’air.

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 171
II) Etude des lipides
1)
:
Présentation
Les lipides présentent plusieurs fonctions biologiques importantes, ils remplissent des
fonctions structurales en tant que composant majeur des biomolécules membranaires.
:
Ils servent de combustibles pour la cellule et pour cela ils interviennent dans des réactions
d’oxydation dans la cellule. Ils jouent un rôle de protection à la surface d’un grand nombre
d’organisme, ils peuvent être aussi des constituants de la surface cellulaire et participer à la
reconnaissance des cellules et jouent un rôle dans l’immunité cellulaire.
Les lipides peuvent être classés de plusieurs façons, et celle qui est la plus satisfaisante est
fondée sur la structure de leur squelette carboné :
- Les lipides complexes qui ne contiennent que des acides gras. Ils sont saponifiables c’est à
dire qu’après hydrolyse alcaline (ajout de soude ou potasse) ils donnent des savons.
- Les lipides simples qui ne contiennent pas d’acide gras. On dit qu’ils sont insaponifiables.
Nous ne retiendrons, cette année, qu'une définition restrictive des lipides :
Les lipides sont des triesters du propan-1,2,3-triol (glycérol) et d'acides carboxyliques.
ou
formule semi-développée représentation topologique
glycérol ou prpopan-1,2,3-triol
2) Nomenclature
Les noms usuels des graisses et des huiles sont souvent déduits de leur origine (saindoux,
huile d'olive, ...).
:
Les noms systématiques (UIPAC) des triesters du glycérol suivent les mêmes règles que
ceux des esters.
Exemple : La stéarine C57O6H110 (trioctadécanoate de propane-1,2,3-trioyle) est utilisé
conjointement a la paraffine (alcanes de plus de 20 atomes de carbone) pour
fabriquer les bougies. La stéarine a pour formule semi-développée :
L'oléine C57O6H104 tiré de l'huile d'olive (trioctadéca-9-ènoate de propane-1,2,3-
trioyle) a pour représentation topologique :

Les lipides
Page 172 Christian BOUVIER
3) Propriétés physiques
a) Température de changement d'état :
:
La fusion des lipides est "pâteuse", progressive avec l'élévation de température.
Les graisses ou les huiles sont, des mélanges de substances à températures de fusion
différentes.
La température de fusion d'un lipide est du même ordre de grandeur que celles des
alcanes de même nombre de carbone.
La température de fusion dépend de la taille du squelette et des insaturations.
La température de fusion est d'autant plus basse que le squelette de la molécule est petit.
Exemple : - tristéarate (groupe résiduel en C15 et saturé) : 65 °C,
- tripalmitate (groupe résiduel en C17 et saturé) : 72 °C,
- trilinoléate (groupe résiduel en C17 et insaturé 3 doubles liaisons) : − 5 °C,
b) Solubilité :
Les lipides sont des biomolécules organiques insolubles dans l’eau, on les extrait des
cellules ou tissus par des solvants non polaires tel que le chloroforme, l’éther, le benzène.
4) Propriétés chimiques des lipides
Les lipides étant des triesters ont les propriétés des esters.
:
On retrouve les réactions suivantes :
a) Hydrolyse :
Les esters s'hydrolysent lentement et très partiellement.
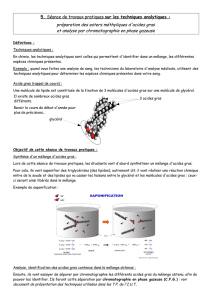
b) Saponification :
La réaction de saponification est la plus importante des lipides.
On peut écrire :
+ 3 (Na+, OH−) → +
savon
Nous avons déjà vu que les propriétés des savons sont liées à la présence de l'ion
carboxylate R – COO− dont une partie est hydrophile (lipophobe) et l'autre partie est lipophile
(hydrophobe) et constitue donc un composé tensioactif.
c) Réaction d'addition sur les lipides insaturés :
Les lipides dont les groupes résiduels sont insaturés par la présence de doubles liaisons
donnent des réactions d'addition.
Lors d'une réaction d'addition, des atomes ou des groupes d'atomes sont ajoutés à la
molécule initiale.
Malgré la diversité des réactions d'addition, elles présentent des caractères communs :
- L'un des réactifs est un composé insaturé (avec double ou triple liaison).
- La molécule de l'autre réactif se scinde en deux fragments qui se fixent de part et d'autre
de la liaison insaturée.
- Le produit obtenu est unique et plus saturé donc de géométrie différente (isomérie
différente) de celle du composé organique initial.

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 173
- Addition d'hydrogène : La réaction est importante dans l'industrie alimentaire. De
nombreuses huiles végétales ou animales sont impropres à la consommation du fait des
insaturations (huile de lin, de graine de coton, de baleine, de foie de morue, ...).
Par hydrogénation catalytique 180 °C, haute pression, catalyseur nickel) on les
transforme en matières grasses comestibles (margarine).
- Addition d'halogène : La réaction d'addition d'iode est totale. Elle est utilisée pour
caractériser le degré d'insaturation des lipides.
Le degré d'iode d'un lipide est la masse (en g) d'iode additionnée par 100 g de lipide.
- Addition d'oxygène : Cette réaction peut se produire lentement et spontanément à l'air
(rancissement du beurre).
d) Propriétés biologiques :
Les lipides sont dégradés, chez l'homme, lors de la digestion par des enzymes (lipases)
pour être transformés en acides gras utilisables par les systèmes sanguin et lymphatique.
La majeure partie va servir à fournir l'énergie à l'organisme, d'autres plus spécifiques vont
contribuer aux bons fonctionnements de certains processus métaboliques.
- Le cholestérol indispensable à la vie est un constituant des membranes qui entourent les
cellules. Il est également indispensable à la fabrication des hormones produites par les
glandes génitales et surrénales.
Cependant, l'excès de cholestérol (et d'autres lipides) dans le sang conduit à la
formation de plaques sur la paroi des artères : c'est l'athérosclérose.
Les graisses saturées doivent donc être évitées car elles augmentent le taux de mauvais
cholestérol (le LDL-cholestérol).
- Les acides gras insaturés : la qualité des graisses consommées est plus importante que
leur quantité. En effet, les graisses les plus bénéfiques pour la santé sont les acides
mono-insaturés et polyinsaturés.
Un acide gras est qualifié d'"essentiel" lorsque l'organisme ne peut le fabriquer qu'en
petite quantité voire pas du tout. Les acides gras essentiels doivent, par conséquent,
être apportés par la nourriture quotidienne ou par une "supplémentation" appropriée.
Parmi les acides gras essentiels citons l'acide linoléique et l'acide α-linolénique.
Ils sont indispensables à notre santé et servent de précurseurs à la synthèse d'autres
acides gras indispensables.
L'acide linoléique fait partie de la famille des acides gras omega-6.
Il est physiologiquement inactif avant que notre organisme ne l'ait catalysé en autres
acides gras omega-6 : acide gamma-linoléique (AGL), acide dihomo-gamma-linoleique
(ADGL) et l'acide arachidonique (AA).
L'acide alpha linolénique appartient à la famille des acides gras omega-3.
Les autres acides gras omega-3 sont synthétisés par notre organisme à partir de l'acide
alpha linolénique.
Ils comprennent l'acide eïcosapentaénoïque (EPA) et l'acide docosahexaénoïque (DHA).
Les acides omega-3 se trouvent en quantités importantes dans les poissons gras ce qui
expliquerait un faible taux de maladies cardiovasculaires dans les populations qui
consomment beaucoup de poissons.
Un apport correct en vitamines et minéraux est nécessaire à la transformation des ces
deux acides gras indispensables en d'autres acides gras.
L’alimentation moderne comporte de nombreuses graisses saturées, un faible taux
d’oméga-3 au détriment d’un taux plus important d’oméga-6.
 6
6
 7
7
 8
8
1
/
8
100%