UE9-JJH-Mecanismes_effecteurs_de_l_immunite_innee_partie_2

UE9 – Immunologie et Immunopathologie
JJ. Hoarau
Date : 18/03/2016 Plage horaire : 10h45-12h45
Promo : P2 2015-2016 Enseignant : JJ. Hoarau
Ronéistes : Laurianne Tailammé
Romain Boother
Mécanisme effecteurs de l'immunité innée
I. Cellules effectrices non spécifiques
1. Polynucléaires neutrophiles
2. Complexe monocyte/macrophages
II. Mécanisme de la phagocytose
1. Chimiotactisme
2. Opsonisation

I. Cellules effectrices non spécifiques
Les cellules de l’immunité innée sont les phagocytes. Les cellules phagocytaires ou phagocytes comprennent
les polynucléaires neutrophiles et les cellules du système monocytes-macrophages.
1. Polynucléaires neutrophiles
Ils se trouvent dans le sang (circulation : 8-10h), peu dans les tissus mais rapidement mobilisés au foyer
infectieux.
Ils ont principalement une action antibactérienne et antifongique, en cas d'infection leur nombre augmentent
rapidement (hyperleucocytose) et ils migrent dans le tissu enflammé/infecté.
Ils permettent la phagocytose puis la formation d'un phagosome ou se déroule un burst oxydatif : activation
d'enzymes hydrolytiques et d'espèces de l'O2 activées.
Ils présentent des granulations primaires azurophiles plus grosses et plus riches en enzymes de type
peroxydase (burst oxydatif) et lysozyme et des granulations secondaires de type collagénase, lactoferrine
(fer nécessaire pour développement des bactéries) et lysozyme.

2. Complexe monocyte – macrophages
500 à 1000 par μl de sang = 6-10% Leucocytes circulant.
Les monocytes circulant dans le sang migrent dans les tissus et se différencient en macrophages de façon
tissu-dépendante.
Ils se différencient en augmentant sa taille d'un rapport de 5 à 10, son nombre d'organites intracellulaires
augmente et se complexifie, ses capacités phagocytaire s'améliorent, ils produisent plus d'enzymes
hydrolytiques et sécrètent des facteurs solubles (cytokines).
Ils se différencient et résident en macrophages alvéolaires au poumon, histiocytes dans le tissu conjonctif, en
cellules mésengliales dans les reins, en cellules de Küpfer dans le foie, en microglie dans le cerveau et en
ostéoclastes dans l'os mais il existe tout de même des macrophages libres circulants.
Les macrophages activés produisent des protéines cytotoxiques et agiront sur les agents pathogènes, cellules
infectées par les bactéries intracellulaires ou par les virus et sur les cellules tumorales.
Les macrophages ont pour fonction :
- de recruter d'autres cellules
- la production de cytokines et de chimiokines (inflammation)
- la fonction d'éboueur (scavenger)
- phagocytose et lyse après que les mécanismes bactéricides soient activés
- rôle de présentateur d'antigène
Les macrophages ont une bonne mobilité et plasticité : ils se déforment et émettent des pseudopodes
(évagination).
Le macrophage est surtout caractérisé par son envie de phagocyter tout ce qui bouge, il peut phagocyter
même des gouttes d'huiles dans le corps (c'est ça le souci). Ils peuvent devenir anarchiques et ingérer nos
propres cellules ou encore des cristaux aboutissant à des maladies inflammatoires.

II. Mécanisme de phagocytose
Étapes de la phagocytose par un macrophage : cette phagocytose donne des débris cellulaires rejeté par le
macrophage donnant la caséum (pus).
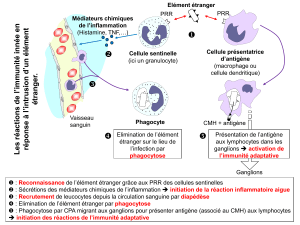
1. Chimiotactisme
Définition : Déplacement des cellules en réponse à un gradient de concentration d'un chimio-attracteur. Le
chimiotactisme concerne les phagocytes et toutes les autres cellules immunitaires.
La première étape dans le fonctionnement d’une cellule phagocytaire, c’est de participer au chimiotactisme
c'est-à-dire être attirée sur le site infectieux pour déclencher le mécanisme inflammatoire ; les nouvelles cel-
lules ayant besoin d’être attirées vers le site infectieux.

Substances chimiotactiques :
Chimiokines : Les chimiokines ou chémokine (un type de cytokine à activité chimioattractante) et parmi ces
chimiokines, on retrouve quelques composés dérivés du complément qui sont les anaphylatoxines (C3a,
C4a, C5a qui ont une capacité chimio-attractante). Elles sont formées de 90 à 130 acides aminés et recon-
nues par récepteur RCPG.
Elles sont très nombreuses mais celles qu'il faut retenir sont :
- IL-8 ou CXCN-8 : recrute des PNN et sera la première à être libérée en masse.
- MIP : recrute des macrophages
- MCP : active les monocytes circulants
- RANTES : action sur les thymocytes
- Produits d'oxydation de la membrane : La phagocytose permet la dégradation des produits altérés de
l’organisme (cellules mortes) et des agents étrangers.
- Peptide N - formyl: retrouvé chez certaines bactéries et attirent les phagocytes. Ce sont des composés qui
peuvent agir directement sur les cellules phagocytaires et qui sont libérés par les bactéries. Ce sont en fait
des produits de dégradation bactérienne et lorsque les protéines des bactéries sont dégradées, il va se former
un composé qui porte une séquence particulière.
Les peptides possèdent ce motif : formyl méthionine leucine phénylalanine (FMLP) reconnu par les phago-
cytes et qui va les attirer vers le site infectieux.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%