UE9 – Immunologie et Immunopathologie JJ. Hoarau

UE9 – Immunologie et Immunopathologie
JJ. Hoarau
Date : 31/03/2017 Plage horaire : 8H30-10H30
Promo : P2 2016-2017 Enseignant : JJ. Hoarau
Ronéistes : LAM-HONG Matthias
ENAULT Mélissa
Mécanisme effecteurs de l'immunité innée (2)
I. Les cellules effectrices non spécifiques
II. La phagocytose
III. Les phagocytes
1. Polynucléaires neutrophiles
2. Complexe monocyte/macrophages
IV. Mécanisme de la phagocytose
1. Chimiotactisme
2. Opsonisation
Annales (page 20 à 30!) (Ne jamais sous-estimer JJH...)
1
1
1

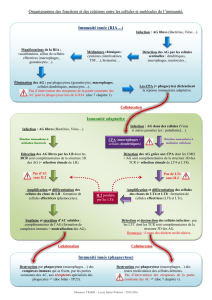
I. Les cellules effectrices non spécifiques
Les cellules effectrices non spécifique de l’immunité innée sont les phagocytes et les cellules tueuses.
Les
phagocytes auront pour fonction principale d’aller capturer des agents pathogènes ou autres éléments
étrangers, et de les digérer de manière interne, tandis que les cellules tueuses vont induire la mort cellulaire
des cellules infectés par contact. Les cellules tueuses seront vue dans le prochain cours
.
II. La phagocytose
Pour revenir en terme d’historique, c’est un scientifique russe Elie
Metchnikoff qui a découvert ces propriétés des cellules phagocytaires
(capacités de certaines cellules à en manger d’autre) en travaillant à
l’institut pasteur. Il a observé que certaines cellules pouvait ingurgité des
cellules bactérienne (mais aussi à tout type d’organisme invasif) et les
éliminer : il a directement donné le terme de phagocytose.
Capacité d’une cellule à manger d’autre, retrouvé même chez des cellules non spécialisées (ex : cellules
fibroblastiques dans certaines conditions
)
Processus qui va permettre à des cellules spécialisées d’aller capturer les cellules et de les internaliser pour
les éliminer. Cela passe par plusieurs étapes :
La reconnaissance de l’agent pathogène, par le biais de récepteurs situé a la surface de la membrane
plasmique. Il existe une multitude de récepteurs, voici quelques exemples :
Les fc récepteurs agissent de manière indirecte en reconnaissant les parties constantes des Ac : ils capturent
les antigènes opsonisés par les Ac.
Les récepteurs des carbohydrates (type mannoses/ fucoses/..etc) reconnaissent les motifs glucidiques des
agents pathogènes.
2

Les récepteurs de type éboueurs : ils interviennent dans la capture des cellules sénescentes.
Ensuite la cellule va capturer le corps étranger en l’englobant par des déformations membranaires. La
cellule va faire des évaginations (déformation vers l’extérieur) sous forme de pseudopodes.
Une fois ramené vers le corps cellulaire, ces évaginations vont former une vacuole d’endocytose qu’on
appelle un phagosome.
Le corps étranger sera finalement éliminé par la fusion du phagosome avec des lysosome (contient arsenal
enzymatique, espéces oxygénées réactives (ROS) et nitrés réactive (NOS)..etc) pour former un
phagolysosome.
III. Les phagocytes
Les cellules phagocytaires jouant un rôle majeur, sont les monocytes – macrophage et les
polymorpho-nucléaires neutrophiles.
Ces cellules sont synthétisées dans la moelle, et vont circuler dans le
sang de 8 à 10h en moyenne.
Sur ces images au MGG on
reconnait :
. un PNN : il possède un noyau plurilobé (2 à 6 lobes), un petit cytoplasme avec des granulations violettes.
. des plaquettes et des hématies
. un monocyte avec un gros noyau encoché.
Lorsqu’un monocyte s’installe dans un tissu, il se transforme en macrophage. Il grossit, son noyau occupe
un espace plus faible, mais conserve l’aspect encoché
.
3

1. Polynucléaires neutrophiles
Les PNN restent majoritairement circulante dans le sang pour une durée de 8 à 10h.
Si il y a une réponse inflammatoire, elles seront les 1er cellules du système immunitaire a infiltré
massivement le tissu.
Ils représentent 55 – 75 % des leucocytes circulants, soit 4000 à 10000 pmn par µL de sang.
Ils ont principalement une action antibactérienne et antifongique.
En cas d'infection, leurs nombres augmentent rapidement (=> hyperleucocytose) en phase aiguë. (=>
marqueur de la réaction inflammatoire
)
Ils interviennent dans la phagocytose et dans la formation d'un phagosome dans lequel se déroula le burst
oxydatif par activation d'enzymes hydrolytiques et d'espèces de l'O2 activées.
Ces enzymes et espèces réactives sont contenus dans des
granulations cytoplasmiques :
Les granulations primaires azurophiles sont plus grosses et
plus riches en enzymes de type peroxydase (burst oxydatif)
et lysozyme et les granulations secondaires contiennent des
collagénase (lorsqu’on a besoin de reconstruire le tissu), du
lactoferrine (le fer étant nécessaire au développement des
bactéries) et aussi du lysozyme.
2.
Complexe monocyte – macrophages
Les monocytes circulant dans le sang pendant une dizaine d’heure puis migrent dans les tissus et se
différencient en macrophages de façon tissu-dépendante. Ils représentent entre 6 – 10 % des leucocytes
circulant, soit entre 500 – 1000 monocytes par µL de sang.
Ce sont les cellules qui présente la capacité de phagocytose la plus importante
.
4

Ils se différencient et résident en macrophages alvéolaires au poumon, en histiocytes dans le tissu
conjonctif, en cellules mésengliales dans les reins, en cellules de Küpfer dans le foie, en microglie dans le
cerveau et en ostéoclastes dans l'os mais il existe tout de même des macrophages libres circulants.
En se différenciant en macrophage, il augmente sa taille d'un rapport de 5 à 10, son nombre d'organites
intracellulaires augmente et se complexifie, ses capacités phagocytaires s'améliorent, il produit plus
d'enzymes hydrolytiques et sécrète des facteurs solubles (cytokines).
Une fois installé, il va rester au repos en attente.
Lorsque les macrophages sont activés, ils produisent des protéines cytotoxiques qui agiront sur les agents
pathogènes, sur les cellules infectées par des bactéries ou par des virus intracellulaires et sur les cellules
tumorales.
Il va surtout produire des cytokines en masse de type chimiokines pour attirer d’autres cellules sur le site
infectieux. De plus un macrophage actif pourra libérer ces granulations à l’extérieur, pouvant provoquer
des dommages à nos cellules lors de la réaction inflammatoire.
Les macrophages ont aussi pour fonction :
- de recruter d'autres cellules
- la production de cytokines et de chimiokines (inflammation)
- rôle de présentateur d'antigène
- la fonction d'éboueur (scavenger) (identifier les cellules du soi en fin de vie ex : globule rouge sénescent
)
- phagocytose et lyse après que les mécanismes bactéricides soient activés
Les macrophages ont une bonne mobilité et plasticité : ils se déforment et émettent des pseudopodes
(projection semi-liquide). Ils s’en servent pour se déplacer, entrer en contact et ramener les éléments.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%