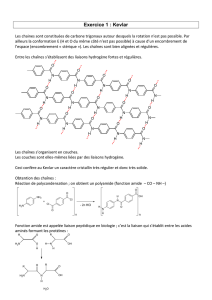
CHAPITRE I
SMC S5
Faculté pluridisciplinaire de Nador

I/ Introduction
L’électrochimie est une discipline qui étudie la relation entre transformations chimiques et passage de courant électrique.
2) domaine d’application:
production d’énergie électrique à partir de réactions chimiques (piles et accumulateurs),
réalisation de réactions chimiques à partir d’énergie électrique (électrolyses),
détection et dosage d’espèces chimiques (électrochimie analytique),
détermination de mécanismes et de cinétique réactionnels (électrochimie organique, corrosion),
1) Définition:
A.BAILAL 2

L’étude des réactions électrochimiques fait appel à des connaissances dans des domaines très variés de la
chimie et de la physique :
électricité
hydrodynamique
...
thermodynamique
cinétique
phénomènes de transport
3) Prérequis
3

L’histoire contemporaine de l’électrochimie est notamment marquée par la compréhension des mécanismes du
transfert électronique (H. Taube, Prix Nobel en 1983 et R.A. Marcus, prix Nobel en 1992).
4) hystorique:
4
Année Inventeur (nationalité) Découverte
1786
Galvani (I)
Electricité «
animale »
1800
Volta (I)
Pile et électrolyse de l’eau
1807
Davy (G.B.)
Sodium
1812
Berzelius (S)
Théorie électrochimique des réactions chimiques
1834
Faraday G.B.)
Lois de l’électrolyse
1836
Daniel (G.B.)
Pile impolarisable
1859
Plante (F)
Accumulateur au plomb
1866
Leclanché (F)
Pile saline Zn
-MnO2
1886
Moissan (F)
Elaboration du fluor
1986
Hall (US) et Heroult (F)
Elaboration de l’aluminium
1888
Nernst (D)
Loi des équilibres électrochimiques
1920
Heyrowsky (CZ)
polarographie
1924
Butler (GB) et Volmer (D)
Lois de la
cinetque electrochimique
prix Nobel de chimie 2019 récompense l'invention des batteries au lithium-ion

1) Demi pile (électrode):
l’interface est le lieu de transfert de charges entre les constituants des deux phases.
II/ Cellules électrochimiques: rappels.
Une électrode est un système constitué de deux phases en contact
un conducteur électronique
(métal ou graphite)
un conducteur ionique
(électrolyte)
Symboles:
Cu │ Cu2+, S042- Pb │ Pb2+, N03-Zn │ Zn2+, S042- Ag │ Ag+, N03-
5
A.Bailal FPN
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
1
/
47
100%