T.D Chimie 4ème M, Sc-exp et Tech
Toutes les solutions sont prises à la température 25°C à la quelle la
valeur de pKe =14
Exercice n°1
Soit un monoacide AH en solution aqueuse diluée, de concentration molaire C.
1)
a) Ecrire l’équation chimique de la réaction de l’acide avec l’eau.
b) Dresser le tableau d’avancement (en utilisant l’avancement volumique y).
c) Exprimer le taux d’avancement final de la réaction de dissolution de l’acide en fonction de son
pH et de sa concentration molaire initiale C.
2) Le tableau ci contre comporte les
renseignements concernant deux solutions
aqueuses diluées (S1) et (S2) d’acides respectifs
A1H et A2H et de même concentration molaire.
a) Calculer le taux d’avancement final de la réaction de dissolution de chaque acide dans l’eau.
b) Montrer que les deux acides sont faibles. Préciser, en le justifiant, l’acide le plus fort.
c) Comparer pKa1 et pKa2.
d) Calculer pKa2 sachant que A2H est faiblement ionisé et que son pH =1
2 (pKa2 – logC).
3) Un prélèvement de volume V2=10 mL de la solution (S2) est soumis à une dilution au
dixième, on obtient ainsi une nouvelle solution S’2 ayant un pH=pH’2.
Voila la liste de matériel pouvant être utile à la dilution :
Fiole jaugée de 50 mL ; fiole jaugée de 100 mL ; pipette à deux traits de jauge de 10mL ; pipette
à deux traits de jauge de 5mL ; de l’eau distillée.
a) Décrire le mode expérimental à suivre, en précisant le matériel choisi parmi << matériel pouvant
être utile à la dilution >>, pour effectuer une dilution au dixième.
b) Calculer la valeur de pH’2. Déduire le taux d’avancement final après dilution.
c) Comparer le taux d’avancement final de la réaction de dissolution de l’acide A2H avant et après dilution.
Conclure.
Exercice n°2
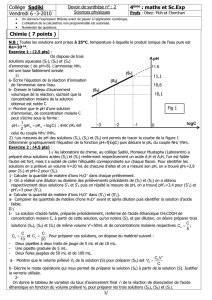
On dispose de trois solutions aqueuses
(S1), (S2) et (S3) d’ammoniac
(de pH>8).
L’ammoniac NH3 est une base
faiblement ionisée
1)
a- Écrire l’équation de la réaction
d’ionisation de l’ammoniac dans l’eau.
b- Dresser le tableau d’avancement
volumique de la réaction, sachant que la
concentration molaire de la solution
obtenue est notée C.
c- Montrer que le pH d’une solution
d’ammoniac, de concentration molaire C
peut s’écrire sous la forme :
pH= 1
2 (pKa + pKe +logC), avec pKa
A1H A2H
pKa1pKa2
C1=3.10-2 mol.L-1 C2= C1
pH
1
=3,10 pH
2
=2,9
0logC
0
,1
1
-1
11,6
(S1)
-
2
pH
(S2)
(S3)
0
,6
1
1
,1
1
-
3
Fig 1
07
,00
pH
-
mètre

T.D Chimie 4ème M, Sc-exp et Tech
2
page
-
est celui du couple NH4+/NH3.
2) Les mesures de pH des solutions (S1), (S2) et (S3) ont permis de tracer la courbe de la figure 1
Déterminer graphiquement l’équation de la fonction pH=f(logC) puis déduire le pKa du couple
NH4+/NH3.
Exercice n°3
I-/
Au laboratoire de chimie, au collège Sadiki, le laborantin a préparé deux solutions acides (S1) et (S2)
renfermant respectivement un acide A1H et A2H, l’un est faible l’autre est fort, mais il a oublié de coller
l’étiquette correspondante sur chaque flacon. Pour identifier les solutions on a prélevé un volume
V=20 mL de chacune d’elles et on a mesuré son pH, on a trouvé pH1=2,9 pour (S1) et pH=2 pour (S2).
1) Calculer la quantité de matière d’ions H3O+ dans chaque prélèvement.
2) On a réalisé une dilution au dixième des prélèvements précédents de (S1) et (S2) on a obtenu
respectivement deux solutions (S’1) et (S’2) puis on répété la mesure de pH, on a trouvé pH’1=3,4 pour
(S’1) et pH’2=3 pour (S’2).
a) Calculer la quantité de matière d’ions H3O+ dans (S’1) et (S’2).
b) Comparer les quantités de matière d’ions H3O+ avant et après dilution puis identifier la solution d’acide
faible.
II-/
1) La solution d’acide faible, préparée précédemment, renferme de l’acide éthanoïque CH3COOH de
concentration molaire C, à partir de cette solution, qu’on notera (S), et par dilution, on désire préparer
trois solutions (Sa), (Sb) et (Sc) de même volume V’=50mL et de concentrations molaires respectives
a
C
C
5
=
;
b
C
C
10
=et
c
C
C
20
=
. Pour préparer ces solutions, on dispose du matériel suivant :
- Deux pipettes à deux traits de jauge de 5 mL et de 10 mL.
- Une pipette graduée de 5 mL.
- Deux fioles jaugées de 50 mL et de 100 mL.
a) Montrer que le volume prélevé Vp de la solution (S) pour préparer (Sb) est
b
p
C V '
V
C
=.
b) Décrire le mode opératoire qui nous permet de préparer la solution (Sb) à partir de la solution (S).
Justifier la verrerie utilisée.
2)
On donne le tableau de variation du taux d’avancement
final τ’f de la réaction de dissociation de l’acide éthanoïque
en fonction du volume prélevé Vp pour préparer les trois
solutions (Sa), (Sb) et (Sc).
a) Compléter le tableau.
b) Tracer le graphe qui représente : log (τ’f) =f (logVp).
3)
a) Dresser le tableau d’avancement volumique de la réaction de l’acide éthanoïque avec l’eau.
b) Établir l’expression du taux d’avancement final τf de la réaction de dissociation de l’acide éthanoïque en
fonction de Ka constante d’acidité du couple CH3COOH/ CH3COO- et C la concentration molaire de l’acide.
(l’acide CH3COOH est faiblement ionisé).
c) Déduire l’expression de τ’f taux d’avancement final de l’acide éthanoïque après dilution en fonction de
Ka, C, V’ (volume de la solution diluée) et Vp( volume prélevé pour préparer la solution diluée).
d) Justifier théoriquement l’allure de la courbe
e) Sachant que le pKa du couple CH3COOH/ CH3COO- est égal à 4,8, déterminer à partir du graphe
tracé, la concentration molaire de la solution initiale de l’acide éthanoïque.
Solution SaSbSc
Vp(mL) 10 …. 2,5
τ’f0,028 0,040 0,056
logVp(mL)
…. …. ….
logτ’
f
…. …. ….

T.D Chimie 4ème M, Sc-exp et Tech
3
page
-
Exercice n°4
On dispose d’une solution d’acide faible AH de concentration molaire C1=7,5.10-2 mol.L-1 ; de volume
V1=100 mL et de pH1=2,46.
1)
a) Écrire l’équation de la réaction d’ionisation de l’acide AH dans l’eau.
b) Reproduire et compléter le tableau d’évolution de la réaction en fonction de l’avancement x.
équation de la réaction AH + H2O …. …. + …
état du système avancement
état initial 0 C1V1 excès 0 0
état final xf …. ’’ …. ….
c)Etablir l’expression du taux d’avancement final τf1 de la réaction en fonction de pH1 et de C1. Montrer
que l’acide est faiblement ionisé.
2)
a) Calculer la concentration molaire des espèces chimiques, autres que l’eau, présentes en solution.
Déduire le pKa1 de l’acide AH.
b) En utilisant le tableau suivant, identifier l’acide AH.
Acide HCOOH NH4+CH3COOH
pKa 3,8 9,2 4,8
3)on considère une solution d’acide benzoïque C6H5COOH de concentration molaire C2=2,5.10-2 mol.L-1
et de pH2=2,9.
a) Calculer le taux d’avancement final τf2.
b)Peut-on comparer les forces des deux acides AH et C6H5COOH. Justifier.
4)
a) établir l’expression du pH d’une solution d’un monoacide faible faiblement ionisé en fonction de son
pKa et de sa concentration molaire C. (avec pH<6).
b) Calculer le pKa du couple C6H5COOH/ C6H5COO- .
c) Comparer la force des deux acides.
5) on prélève un volume V0=20 mL de la solution d’acide AH qu’on introduit dans une fiole jaugée de
100 mL puis on ajoute de l’eau distillée jusqu’au trait de jauge, on prépare ainsi une solution (S).
a) Etablir l’expression de la variation de pH d’une solution d’acide faiblement ionisé lors d’une dilution N
fois.
b) Calculer pH’ de la solution (S).
c) Calculer la valeur du taux d’avancement final τ’f1 de l’acide AH après la dilution. Conclure.
Exercice n°5
On prépare au laboratoire une solution aqueuse S1 d’ammoniac NH3 (base faible) de concentration
initiale C1= 5.10-2 mol.L-1. La mesure du pH donne pH1=10,95.
1) Ecrire l’équation de la réaction de dissociation de l’ammoniac dans l’eau.
2)
a) Dresser un tableau d’avancement de la réaction en fonction de l’avancement volumique final
yf =
xf
V
et C1.
b) Montrer que le taux d’avancement final de dissociation d’une base s’écrit sous la forme τf=
Ke
.10
pH
C
.
3) En négligeant les ions provenant de l’autoprotolyse de l’eau et en considérant que l’ammoniac est
faiblement dissocié dans l’eau,
a) Etablir l’expression de la constante de basicité Kb du couple de l’ammoniac en fonction du taux
d’avancement final τf et de C1.

T.D Chimie 4ème M, Sc-exp et Tech
4
page
-
b) En déduire que le pH de la solution s’écrit : pH = 1
2( pKa + pKe + logC1).
4) On prépare au laboratoire différentes solutions aqueuses d’ammoniac dont on mesure le pH. Les
résultats obtenus sont donnés dans le tableau ci-après:
a) Reproduire puis compléter le tableau ci-dessus.
b) Tracer sur un papier millimétré le graphe représentant l'évolution de la valeur du pH en fonction de
log(C).
On prendra l'échelle suivante:
- en abscisses: 2 cm pour une unité de log(C).
- en ordonnées: 1 cm par unité de grandeur (pH).
c) À l'aide du graphe, déterminer le pKa du couple acide-base de l’ammoniac.
5) Montrer que la dilution favorise l’ionisation d’une base faible.
Solutions S1 S2 S3 S4 S5
C( mol.L-1) 5 .10-2 10-2 5.10-3 10-3 1.10-4
pH 10,95 10,6 10,45 10,1 9,6
logC
1
/
4
100%