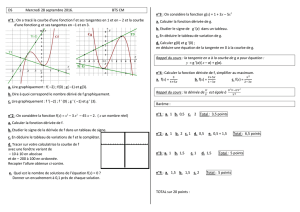
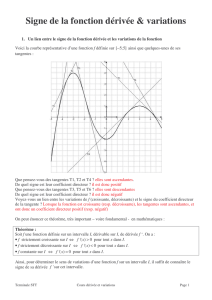
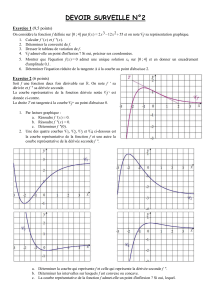
Définition
Définition:
Dans le cas d'un titrage pH-métrique une réaction acido-
basique est mise en jeu entre les réactifs titré et titrant.
Cette réaction doit être rapide et totale.
La réaction de titrage entre un acide et une base devra mettre en
jeu au moins un acide fort ou une base forte afin que la réaction
soit totale.
On trouvera dans le chapitre réactions acido-basiques des
exemples de bases fortes (solution de soude ou de potasse par
exemple) ou d'acides forts (acide chlorhydrique, acide nitrique,
...).
Exemple:Titrage d'une solution d'acide éthanoïque
L'acide éthanoïque appartient au couple acido-
basique avec . Il s'agit donc d'un
acide faible.
La réaction de cette acide faible avec l'eau qui est une base
faible (base du couple ) s'écrit :
Cette réaction conduit à un équilibre caractérisé par la constante
d'équilibre
On ne peut donc pas utiliser cette réaction pour titrer une
solution d'acide éthanoïque.
La réaction de l'acide éthanoïque avec la base forte , qui
provient par exemple d'une solution de soude ( ),
est totale et s'écrit :
Cette réaction avec une base forte permettra de titrer une
solution d'acide éthanoïque.
Méthode:
Au fur et à mesure que la solution titrante est versée dans le
bécher, le pH de la solution est mesuré à l'aide d'un pH-mètre. Il
suffit pour cela de plonger la sonde de l'appareil (composée de 2
électrodes aux bornes desquelles on mesure une tension
proportionnelle au pH) dans la solution à titrer. On considère
généralement qu'une mesure de pH est précise à 0,05 unité près.

Exemple : dosage de l'acide éthanoïque par la base forte
selon la réaction :
Montage du titrage pH-métrique de l'acide éthanoïque par une solution de soude
A chaque ajout de solution titrante effectué :
Le volume de solution titrante sera relevé
La valeur du pH indiquée sur le pH-mètre sera notée
On dressera alors un tableau de valeur :
On trace ensuite la courbe sur une feuille
de papier millimétré, les valeurs de pH étant placées en ordonnée
et les valeurs de volume en abscisse. On peut également utiliser
un logiciel de type tableur pour tracer la courbe à partir des
données du tableau. Un exemple de courbe est donné ci-dessous.

Sur cet exemple de dosage, on remarque que la courbe est
constituée de 2 parties :
une zone où le pH évolue peu en fonction du volume versé
(entourées en bleu)
une zone où le pH évolue fortement en fonction du volume versé
(zone entouré en rouge) : c'est un saut de pH.
Méthode:Méthode des tangentes
Étape 1 : placer 2 tangentes à la courbe de part et d'autre du
saut de pH (au niveau des « arrondis » de la courbe). Ces 2
tangentes doivent être parallèles
Étape 2 : tracer la droite perpendiculaire à ces 2 tangentes
Étape 3 : placer les points A et B d'intersection entre chacune
des tangentes et la perpendiculaire. Mesurer sur cette droite
perpendiculaire le segment [AB] et placer le milieu I de ce
segment
Étape 4 : tracer la parallèle aux 2 tangentes passant par I
Étape 5 : cette dernière droite coupe la courbe pH = f(V) au
point équivalent E. Lire les coordonnées du point équivalent
( )

Étape 1
Étape 2

Étape 3
Étape 4
 6
6
 7
7
 8
8
1
/
8
100%