1
Spectroscopies
Chapitre 11.1 : spectroscopie infrarouge
Chapitre 11.2 : spectroscopie R.M.N du proton
1.1. Historique 3
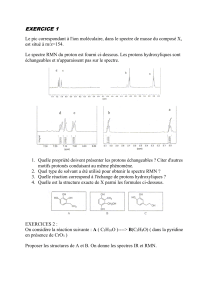
Spectre1.1–Tracedel’oscillographedel’induction nucl´eairedel’´ethanol, La tracetotal est
de 75 milligaussdelargeet travers´een 2 secondes. Lespicsde gauche `a droiterepr´esentent
OH, CH2,CH3.a
atraduction litt´erale de la l´egende originale
Les chimistescommenc`erent `a s’int´eresser `a cette technique avec l’article de
Packard et al.8qui rapportelefameux spectredel’´ethanol (spectre1.1)et lescarac-
t´eristiquesdesspectresdesm´ethanol, ´ethanol, propan-1-ol, butan-1-ol, pentan-1-ol,
signalant deprobables superpositions de signaux.
Il fallut attendre 1951 pour que Varian commercialise le premier spectrom`etre
haute r´esolution, le Varian A-60, suivi en 1964 par un mod`ele `a aimant supracon-
ducteur fournissant un champ stable et homog`ene `a 220 MHz proton, am´eliorant
ainsi la r´esolution.
L’augmentation du champ permet aussi une meilleuresensibilit´een augmentant
l’´ecart entre les niveaux d’´energies (´equation 1.1.a). L’intensit´edu signal d´epend
de la di↵´erence de population entre lesdeux niveaux d’´energie; ainsi plus l’´ecart
entre les niveaux est important plusl’´ecart entre les populationsdecesniveaux est
important. Latransition d’un niveau versl’autren´ecessitant plus d’´energie, (voir le
chapitre 1.2.3).
Danslesann´ees60,l’id´eed’utiliser lasommedeplusieursacquisitionsafin d’aug-
menterlerapport signal sur bruit se heurte `a des probl`emes de dur´ee d’exp´erience.
En 1963, Anderson travaille sur un spectrom`etre `a multiples canaux, permettant
8Arnol d,J.T.; Dhar matti,S.S.; Packar d,M.E.J. Chem. Phys. 1951,19,507.
Cours de chimie de première période de PCSI

2
Chimie organique
Chapitre
11.2
Résonance Magnétique Nucléaire
I HISTORIQUE : DES PREMIERES EXPERIENCES EN 1945 A AUJOURD’HUI…............................... 3
II PRINCIPES GENERAUX DE LA RMN ........................................................................................................ 4
1. QU’EST-CE QUE LA RESONANCE MAGNETIQUE NUCLEAIRE ? ................................................................................ 4
2. QUELS SONT LES NOYAUX CAPABLES DE PRODUIRE UNE TELLE RESONANCE ? ................................................. 4
3. QUANTIFICATION DES NIVEAUX D’ENERGIE ............................................................................................................. 5
III PRINCIPE D’UN SPECTROMETRE : ACQUISITION D’UN SPECTRE DE RMN PULSEE A
TRANSFORMEE DE FOURIER ..................................................................................................................... 12
IV PRESENTATION D’UN SPECTRE DE R.M.N : DEPLACEMENT CHIMIQUE ................................ 13
1. RESONANCE D’UN PROTON ET DEPLACEMENT CHIMIQUE ............................................................................. 13
2. PROTONS CHIMIQUEMENT EQUIVALENTS ; PROTONS MAGNETIQUEMENT EQUIVALENTS. ............................ 18
V COUPLAGE SPIN-SPIN, MULTIPLETS ................................................................................................... 20
1. SYSTEME AMXP ............................................................................................................................................................ 21
2. SYSTEME AMMPXQ ...................................................................................................................................................... 27
3. ABSENCE DE COUPLAGE AVEC LES PROTONS « LABILES », PROTONS PORTES PAR DES ATOMES D’OXYGENE,
DE SOUFRE ET D’AZOTE. ................................................................................................................................................. 30
VI UNE INDICATION IMPORTANTE : LA COURBE D’INTEGRATION ............................................. 31
VII CONCLUSION : MARCHE A SUIVRE POUR ELUCIDER UNE STRUCTURE ............................... 31
Le Plan du cours

3
I Historique : des premières expériences en 1945 à aujourd’hui…
Les premières expériences de RMN ont été conduites à la fin de l'année 1945 par deux
équipes américaines. Les premiers résultats furent publiés dans les premiers mois de
1946 par Edward M. Purcell et Félix Bloch. Leurs travaux leur valurent conjointement le
Prix Nobel de Physique en 1952.
C'est seulement au début des années 1970 que la méthode RMN prit son essor grâce aux
travaux du suisse Richard R. Ernst (Prix Nobel de Chimie en 1991).

4
Aujourd’hui, la technique RMN est devenue un outil très précieux du diagnostic médical
des tissus. Les examens pratiqués sot des examens par IRM, ou Imagerie par Résonance
Magnétique, sigle permettant de « masquer » le mot Nucléaire auprès du grand public…
Cette présentation de la RMN est rapide et nécessairement incomplète. Nous dirons
simplement que la RMN est bien l'expérience de physique qui a révolutionné l'analyse
chimique.
II Principes généraux de la RMN
1. Qu’est-ce que la résonance magnétique nucléaire ?
La résonance magnétique nucléaire (RMN) est une technique spectroscopique qui
nous permet de détecter les noyaux atomiques, et qui nous dit dans quel type
d'environnement ces noyaux se trouvent à l'intérieur d’une molécule.
Certains noyaux atomiques se comportent en effet comme de minuscules aimants et ils
possèdent des niveaux d'énergie différents quand on les place dans un champ
magnétique.
Notre noyau atomique est plus limité qu’un aimant : ses niveaux d'énergie sont
quantifiés, exactement comme les niveaux d'énergie de l'électron dans l’atome. Quand il
passe d’un niveau d’énergie favorable à un niveau d’énergie défavorable, on dit
qu’il y a résonance.
2. Quels sont les noyaux capables de produire une telle résonance ?
Le noyau auquel nous nous intéresserons est celui de l'atome 1H : notre étude est limitée
à la R.M.N du proton, RMN-1H, mais il faut savoir qu'il existe d'autres R.M.N, telles
celles du carbone-13 13C, du fluor-19 19F, ou aussi de l’hydrogène-3 3H tritium.
Tous les noyaux qui interagissent avec les champs magnétiques possèdent un moment
de spin nucléaire. Ce moment de spin nucléaire est noté
I
et est plus simplement appelé
« spin nucléaire ».
Par suite, ces noyaux possèdent ainsi un moment magnétique nucléaire
µ
. Les deux
grandeurs sont liées entre elles par l'équation :
h
µ=γ. .I γ. .I
2.π
est appelé rapport gyromagnétique du noyau.
Pour le proton : = 2,675221.108 rad.s-1.T-1
Un noyau atomique possède un spin nucléaire, caractérisé par le nombre I, dès que A,
son nombre de masse, et Z, son numéro atomique, ne sont pas pairs tous les deux.

5
Les noyaux dont le spin est nul n'ont aucune propriété magnétique et ne sont pas
détectables. Tous les noyaux dont le spin n'est pas nul se comportent alors comme de
petits aimants lorsqu'ils sont placés dans un champ magnétique. Ce magnétisme
nucléaire est beaucoup plus petit que le magnétisme électronique : environ 2000 fois.
Figure 1 : le noyau se comporte
comme un petit aimant dans
un champ magnétique vertical
Figure 2 : les lignes de champ magnétique
d’un noyau sont semblables à celles d’un
petit aimant.
Dans le tableau suivant, on rapporte les noyaux possédant des propriétés magnétiques,
ainsi que la valeur de leur spin nucléaire :
Noyaux
Nombre de
neutrons (N) et de
protons (Z)
Nombre
(quantique) de
spin I
Norme du spin
nucléaire
I
I.(I+1)
12C 16O
Z pair
Z pair
0
0
Non magnétique
1H 13C 15N 19F 31P
Z + N impair
1/2
3
4
= 0,87
2H 14N
Z impair
N impair
1
1
2
=1,41
Noyau
1
1H
1
2H
5
11B
6
13C
7
14 N
8
17 O
9
19F
17
35Cl
Spin I
1/2
1
3/2
1/2
1
1/2
1/2
3/2
On remarque que le carbone 12C, si important en chimie organique, ne donne pas de
signal de résonance. Pour cette raison, l'obtention d'un signal de résonance du carbone
est limitée à son isotope 13C (abondance naturelle : 1,1 %).
Dans toute la suite, on ne s’intéressera qu’au proton, et par conséquent, nous étudierons
le principe de la Résonance Magnétique Nucléaire du proton.
3. Quantification des niveaux d’énergie
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%