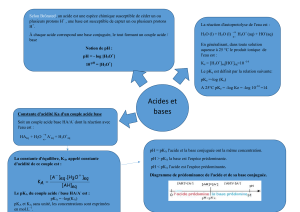
CORRECTION des EXERCICES SUR ACIDE FAIBLE ET BASE FAIBLE
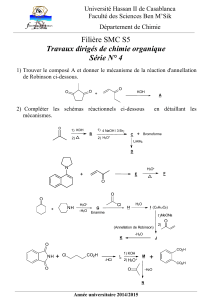
Exercice 1 :
1. Définition d’un acide, d’une base.
un ACIDE est un corps qui LIBERE H+ .
une BASE est un corps qui FIXE H+ .
2. Définition d’un couple acide/base :
HA →
← H+ + A–
Couple acide /base : HA/A– (HA est l’acide et A– est la base conjuguée)
B + H+ →
← BH+
Couple acide /base : BH+/B (BH+ est l’acide conjugué de la base B)
3. Donner les formules chimiques des bases conjuguées des acides suivants :
a) H-COOH / H-COO– b) C6H5-COOH / C6H5-COO–
c) HCN / CN– d) HF / F–
e) HNO2 / NO2– f) H2PO4— / HPO42–
4. Donner les formules chimiques des acides conjugués des bases suivantes :
a) C2H5-NH3+ / C2H5-NH2 b) H2O / HO–
c) HS– / S2— d) H3O+ / H2O
e) CH2Cl-COOH / CH2Cl-COO– f) H3PO4 / H2PO4—
Exercice 2 : Écrire les réactions d’ionisation avec l’eau des acides suivants :
1. Acide propanoïque (faible)
CH3-CH2-COOH + H2O →
← H3O+ + CH3-CH2-COO–
2. Acide nitrique (fort)
HNO3 + H2O → H3O+ + NO3–
3. Acide méthanoïque (faible)
H-COOH + H2O →
← H3O+ + H-COO–
4. L’ion hydrogénocarbonate HCO3— (faible)
HCO3– + H2O →
← H3O+ + CO32–
Exercice 3 : Écrire les réactions d’ionisation avec l’eau des bases suivantes :
1. Méthylamine (faible)
CH3-NH2 + H2O →
← CH3-NH3+ + HO–
2. Potasse KOH (forte)
KOH → K+ + HO–
3. L’ion ethanoate CH3-COO—(faible)
CH3-COO– + H2O →
← CH3-COOH + HO–
4. L’ion hydrogénocarbonate HCO3— (faible)
HCO3– + H2O →
← H2CO3 + HO–
Exercice 4 : 1. pH = 4,5 ⇒ [ ]
H3O+ = 10–2,7 = 3,16 . 10–5 moL.L–1
solution d'acide HA : [ ]
HA = 10–3 mol.L–1
On constate que [ ]
H3O+ < [ ]
HA donc l’acide est FAIBLE (partiellement dissocié)
2. HA + H2O →
← H3O+ + A–
3. Concentrations :
⇒ pH = 4,5 ⇒ [ ]
H3O+ = 10–2,7 = 3,16 . 10–5 moL.L–1

⇒ [ ]
HO– = Ke
[ ]
H3O+ = 10–14
3,16 . 10–5 ⇒ [ ]
HO– = 3,16 . 10–9 mol.L–1
⇒ Electroneutralité : [ ]
H3O+ = [ ]
A– + [ ]
HO–
Comme [ ]
HO– est ultraminoritaire : [ ]
A– = [ ]
H3O+ = 3,16 . 10–5 moL.L–1
⇒ Conservation de la matière :
[ ]
HA ini = [ ]
A– + [ ]
HA fin ⇒ [ ]
HA fin = [ ]
HA ini – [ ]
A–
[ ]
HA fin = 10–3 – 3,16 . 10–5 ⇒ [ ]
HA fin = 0,968 . 10–3 mol.L–1
ce qui prouve bien que l’acide est très partiellement dissocié.
4. Degré d’ionisation : α = [ ]
A–
[ ]
HA ini = 3,16 . 10–5
10–3 ⇒ αα = 3,16 %
Exercice 5 :
1. Dissolution : NH3 + H2O →
← NH4+ + HO–
* n = v
Vm = 2,24
22,4 = 0,1 mol
* c = [ ]
NH3ini = n
V = 0,1
0,5 ⇒ c = 0,2 mol.L–1
2. pH = 11,25
2.1. [ ]
HO– = Ke
[ ]
H3O+ = Ke
10–pH = 10–14
10–11,25 ⇒ [ ]
HO– = 1,78.10–3 mol.L–1
Conclusion : [ ]
HO– < [ ]
NH3ini la base est FAIBLE (partiellemnt dissociée)
2.2. Concentrations :
* [ ]
H3O+= 10–pH = 10–11,25 ⇒ [ ]
H3O+ = 5,6.10–12 mol.L–1
* [ ]
HO– = Ke
[ ]
H3O+ ⇒ [ ]
HO– = 1,8.10–3 mol.L–1
* Electroneutralité : [ ]
H3O+ + [ ]
NH4+ = [ ]
HO–
Comme [ ]
H3O+ est ultra minoritaire ⇒ [ ]
NH4+ = [ ]
HO–= 1,8.10–3 mol.L–1
* Conservation de la matière : [ ]
NH3ini = [ ]
NH4+ + [ ]
NH3fin
⇒ [ ]
NH3fin = [ ]
NH3ini – [ ]
NH4+ = 0,2 - 1,78.10–3
⇒ [ ]
NH3fin = 0,198 mol.L–1 == c
Degré de dissociation : α = [ ]
NH4+
[ ]
NH3ini = 1,78.10–3
0,2 ⇒ αα = 0,89 %
Exercice 6 : Equation de la réaction acide-base et allure de la courbe pH = f(v) :
1. Éthylamine (faible) + acide chlorhydrique (fort)
CH3CH2-NH2 + H3O+ + Cl– →
← H2O + CH3CH2-NH3+ + Cl–
2
1

2. Éthanoïque (faible) + solution potasse (KOH base forte)
CH3-COOH + (K+ + HO–) →
← H2O + (K+ + CH3-COO–)
3. Acide chlorhydrique + solution de soude (forte)
(H3O+ + Cl–) + (Na+ + HO–) → 2 H2O + (Na+ + Cl–)
4. Solution NH3 (faible) + acide nitrique (fort)
NH3 + (H3O+ + NO3–) →
← H2O + (NH4+ + NO3–)
3 4
1
/
3
100%