TP7 Dosage des ions hydrogénocarbonate dans de l’eau minérale
_________________________________________________________________________________________
Objectif
À l’aide du matériel mis à votre disposition, VOUS ÊTES CHARGÉ DE VÉRIFIER SI LA CONCENTRATION
MASSIQUE EN IONS HYDROGÉNOCARBONATE DANS L’EAU MINÉRALE EST CONFORME À
L’INDICATION PORTÉE SUR L’ÉTIQUETTE.
Principe
Lorsque l’on ajoute une solution d’acide chlorhydrique dans une solution contenant des ions hydrogénocarbonate, en
présence d’un indicateur coloré, la solution change de couleur pour un certain volume V d’acide versé.
On dit que l’on effectue un dosage colorimétrique.
Informations théoriques
Les ions hydrogénocarbonate ont pour formule HCO3- et sont couramment appelé bicarbonate.
Le vert de bromocrésol est un indicateur coloré acido-basique.
On utilisera une solution d’acide chlorhydrique qui a pour formule (H+ + Cl-).
L'équation simplifiée de cette réaction de titrage est :
HCO3- + H+ → CO2 (aq) + H2O (l) (il s’agit de dioxyde de carbone dissous dans l’eau qui peut devenir gazeux)
Protocole opératoire
1. Remplir jusqu’au « zéro » une burette graduée avec la solution d'acide chlorhydrique. (Attention au ménisque !)
2. Mesurer V0 = 20,0 mL d'eau minérale avec une pipette jaugée munie d’une poire à pipeter.
3. Mettre cette quantité d’eau ainsi qu’un barreau aimanté et une dizaine de gouttes d’un indicateur coloré appelé vert de
bromocrésol dans un bécher.
4. Placer le bécher sur l’agitateur magnétique.
5. Le bécher est placé sous la burette.
6. Poser une feuille de papier blanc sous le bécher pour bien voir le changement de couleur.
7. Ajouter, goutte à goutte, la solution d'acide chlorhydrique contenue dans la burette jusqu’au virage (ou changement
de couleur) de l’indicateur coloré.
8. Faire deux dosages : un rapide et un précis.
Exploitation des résultats
1. Quelle valeur (en mL) retenez-vous pour le volume V d’acide versé correspondant au changement de couleur du
milieu réactionnel ?
2. Quelle est, ici, la couleur de l’indicateur coloré : au début du dosage ? à la fin du dosage ?
3. Sachant que chaque millilitre d’acide versé, correspond une concentration massique en ions
hydrogénocarbonate égale à 0,0305 g/L, en déduire la concentration massique C (en mg/L) en ions
hydrogénocarbonate dans l’eau dosée.
4. Comparer cette valeur à celle portée sur l'étiquette de la bouteille. (< ou = ou > ?)
5. Calculer l’écart entre ces deux résultats à l’aide de la formule :
(C’est en valeur absolue donc le résultat est >0 et exprimé en %)
6. Conclure quant à la validité de votre dosage et faire la liste de toutes les causes d’erreurs expérimentales.
(Indice: on notera aussi la précision de la verrerie utilisée).
% d’écart = | Valeur sur l’étiquette – Valeur expérimentale | x 100
Valeur sur l’étiquette
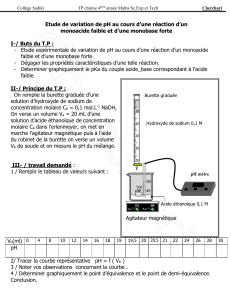
Burette graduée
Acide chlorhydrique
Eau + indicateur
ccoloré
Agitateur
magnétique
Turbulent
Dispositif
d’observation (œil)

Matériel
9 groupes :
- 1 agitateur magnétique avec barreau aimanté.
- 1 burette 25 mL sur support.
- 1 pissette d'eau distillée.
- 2 pots yaourt
- 2 béchers moyens en verre.
- propipette
- feuilles papier filtre
- 1 chiffon
- petite pipette plastique
Prof :
- Evian. + Contrex + Hépar
- 1 petit flacon de vert de bromocrésol
- 2 L d'une solution d'acide chlorhydrique à 0,010 mol.L-1
- les tiges aimantées
- 9 pipettes jaugées 20 mL
- 4 pipettes graduées de 10 mL
- 9 grands béchers plastiques
- papier filtre
chiffons
1
/
2
100%