Traumatisme pelvien et urgences vasculaires : Embolisation artérielle
Telechargé par
rellyc

Journal
de
Radiologie
Diagnostique
et
Interventionnelle
(2015)
96,
273—285
FORMATION
MÉDICALE
CONTINUE
:
LE
POINT
SUR.
.
.
Traumatisme
du
pelvis
et
urgences
vasculaires夽
U.
Scemama∗,
A.
Dabadie,
A.
Varoquaux,
J.
Soussan,
C.
Gaudon,
G.
Louis,
K.
Chaumoître,
V.
Vidal
Service
d’imagerie
médicale
diagnostique
et
interventionnelle,
hôpital
La
Timone,
264,
rue
Saint-Pierre,
13005
Marseille,
France
MOTS
CLÉS
Bassin
;
Pelvis
;
Polytraumatisme
;
Embolisation
Résumé
Les
traumatismes
de
l’anneau
pelvien
sont
responsables
d’une
mortalité
élevée,
et
l’exsanguination
en
est
la
principale
cause
dans
les
24
premières
heures.
La
prise
en
charge
du
blessé
s’intègre
dans
une
stratégie
de
damage
control,
multidisciplinaire.
Le
patient
instable
doit
bénéficier
sans
délai
d’une
hémostase
instrumentale,
dont
l’artério-embolisation
constitue
un
moyen
efficace,
justifiant
sa
disponibilité
permanente
dans
les
trauma-centers
de
niveau
1.
Le
patient
stable
pourra
bénéficier
après
un
bilan
lésionnel
au
moyen
de
la
tomodensitométrie
d’une
artério-embolisation
s’il
existe
un
saignement
actif
artériel
ou
une
lésion
vasculaire.
Les
modalités
d’embolisation
(sélective
ou
non
sélective)
et
les
agents
d’embolisation
utilisés
dépendent
de
l’état
hémodynamique
du
patient
et
du
bilan
lésionnel
s’il
a
pu
être
effectué.
©
2015
Éditions
franc¸aises
de
radiologie.
Publié
par
Elsevier
Masson
SAS.
Tous
droits
réservés.
DOI
de
l’article
original
:
http://dx.doi.org/10.1016/j.diii.2015.05.004.
夽Ne
pas
utiliser,
pour
citation,
la
référence
franc¸aise
de
cet
article,
mais
celle
de
l’article
original
paru
dans
Diagnostic
and
Interventional
Imaging,
en
utilisant
le
DOI
ci-dessus.
∗Auteur
correspondant.
Adresse
e-mail
:
(U.
Scemama).
http://dx.doi.org/10.1016/j.jradio.2015.06.003
2211-5706/©
2015
Éditions
franc¸aises
de
radiologie.
Publié
par
Elsevier
Masson
SAS.
Tous
droits
réservés.

274
U.
Scemama
et
al.
Généralités
Épidémiologie
des
traumatismes
du
pelvis
Les
traumatismes
sont
à
l’origine
de
10
%
des
décès
dans
le
monde
[1].
Ils
constituent
la
première
cause
de
morta-
lité
chez
les
personnes
de
5
à
44
ans
[2]
et
sont
2,4
fois
plus
fréquents
chez
les
hommes
que
chez
les
femmes.
Les
traumatismes
du
pelvis
sont,
dans
80
%
des
cas,
la
conséquence
d’accidents
de
la
route
(50
%
de
voiture,
20
%
de
2
roues
et
30
%
de
piéton),
dans
10
%
de
chutes,
dans
8
%
d’écrasements
et
dans
2
%
d’autres
causes.
Neuf
patients
sur
10
ont
une
lésion
extrapelvienne
associée
[3].
La
mortalité
des
traumatismes
de
l’anneau
pelvien
peut
être
imputable
à
l’exsanguination
d’origine
pelvienne,
aux
lésions
traumatiques
associées
[4,5]
ou
aux
complications
du
traumatisme
et
de
la
réanimation
(syndrome
de
détresse
respiratoire
aiguë,
défaillance
multiviscérale,
sepsis)
[6].
Lorsque
la
mortalité
est
directement
liée
au
traumatisme
de
l’anneau
pelvien,
elle
est
d’autant
plus
élevée
(25
%)
que
la
fracture
est
instable
[7]
et
que
l’état
hémodynamique
initial
est
également
instable
(30
à
45
%)
[8].
Exsanguination
lors
des
traumatismes
pelviens
L’exsanguination
par
saignement
massif,
défini
par
la
perte
d’un
volume
sanguin
corporel
en
24
heures
ou
d’un
demi-
volume
sanguin
en
3
heures,
constitue
la
première
cause
de
mortalité
dans
les
24
premières
heures
(30
à
40
%)
[9].
Plusieurs
facteurs
favorisent
la
survenue
d’un
saignement
massif.
Ils
sont
liés
au
traumatisme
(sites
et
nombre
de
sai-
gnements
ou
de
lésions
vasculaires),
aux
conséquences
du
traumatisme
(coagulopathie
par
consommation,
hypother-
mie
et
acidose)
et
au
patient
(comorbidités,
traitements
antiagrégants
plaquettaires
et/ou
anticoagulants
et
possi-
bilité
ou
non
de
les
arrêter)
[10].
L’exsanguination
est
la
conséquence
de
lésions
vascu-
laires
et
résulte
majoritairement
d’un
saignement
osseux
lors
de
déplacements
fracturaires
ou
d’un
saignement
vei-
neux
par
lésion
du
plexus
veineux
pré-sacré
(traumatisme
direct
par
un
fragment
osseux
ou
traumatisme
indirect
par
cisaillement).
Dans
10
à
20
%
des
cas,
et
jusqu’à
60
%
des
cas
lorsqu’il
existe
une
instabilité
hémodynamique,
un
saignement
arté-
riel
est
présent
[11—15].
Les
veines
étant
plus
fragiles
que
les
artères,
lorsqu’il
existe
un
saignement
artériel,
un
sai-
gnement
veineux
est
toujours
associé
[16,17].
Contrairement
aux
études
sur
sujets
sains,
dans
les
trau-
matismes
instables
de
l’anneau
pelvien,
le
rétropéritoine
ne
permet
pas
l’auto-tamponnade
et
l’arrêt
des
saignements
osseux
et
veineux,
qui
peuvent
ainsi
conduire
à
une
exsan-
guination
en
l’absence
d’hémostase
instrumentale.
Les
saignements
artériels
dépassent
les
capacités
de
tamponnade
de
l’espace
rétropéritonéal
et
conduisent
à
une
exsanguination
en
l’absence
d’hémostase
instrumentale
[18,19].
Classifications
des
traumatismes
pelviens
Les
classifications
des
traumatismes
de
l’anneau
pelvien
les
plus
fréquemment
utilisées,
celles
de
Young-Burgess
[20]
et
de
Tile
[21],
guident
la
prise
en
charge
chirurgicale
en
termes
de
stabilisation
de
l’anneau
pelvien,
en
utilisant
le
mécanisme
lésionnel
et
la
stabilité
du
traumatisme.
On
dis-
tingue
ainsi
les
fractures
en
compression
antépostérieure,
responsables
d’une
ouverture
de
l’anneau
comme
un
livre
ouvert,
les
fractures
en
compression
latérale,
responsables
d’une
fermeture
de
l’anneau,
les
instabilités
verticales
et
les
mécanismes
combinés.
Mais
elles
ne
permettent
pas
d’établir
une
corrélation
entre
le
type
de
fracture
et
la
nécessité
d’une
hémo-
stase
instrumentale,
quelle
qu’en
soit
la
technique.
Certains
auteurs
rapportent
cependant
un
lien
entre
la
stabilité
de
l’anneau
pelvien
(quel
que
soit
le
mécanisme
fracturaire)
et
l’identification
d’un
saignement
actif
artériel
[14,22—24].
Prise
en
charge
initiale
du
traumatisé
de
l’anneau
pelvien
L’état
hémodynamique
initial
conditionne
la
prise
en
charge
et
distingue
trois
catégories
de
patients
[25]
(Fig.
1)
:
•catégorie
1
:
les
patients
avec
instabilité
hémodynamique
par
choc
hémorragique,
c’est-à-dire
avec
un
syndrome
hémorragique
ne
répondant
pas
au
remplissage
vascu-
laire
(persistance
d’une
tension
artérielle
inférieure
à
90
mmHg
et/ou
d’une
tachycardie
supérieure
à
120
bpm)
;
•catégorie
2
:
les
patients
avec
syndrome
hémorragique
répondant
au
remplissage
vasculaire
et
restant
dépen-
dants
de
celui-ci
;
•catégorie
3
:
les
patients
avec
syndrome
hémorragique
stabilisés
par
un
remplissage
vasculaire
ou
sans
syndrome
hémorragique.
Patient
avec
instabilité
hémodynamique
(catégorie
1)
Le
délai
nécessaire
au
contrôle
de
l’hémorragie
influence
directement
la
mortalité
[26,27].
Un
patient
présentant
un
choc
hémorragique
et
une
source
de
saignement
identifiée
(saignement
extériorisé)
doit
bénéficier
sans
délai
d’un
contrôle
instrumental
du
sai-
gnement.
Un
patient
présentant
un
choc
hémorragique
sans
source
de
saignement
identifiée
doit
bénéficier
d’un
bilan
lésion-
nel
par
Focused
Abdominal
Sonography
in
Trauma
(FAST)
et
d’une
radiographie
du
thorax
et
du
bassin
en
salle
de
déchocage.
Un
épanchement
péritonéal
significatif
en
FAST
indique
une
laparotomie
d’hémostase
sans
délai.
L’absence
d’épanchement
péritonéal
significatif
en
FAST
et
la
présence
d’un
traumatisme
de
l’anneau
pelvien
indiquent
une
hémostase
instrumentale
du
saignement
pré-
sumé
pelvien
sans
délai.
En
première
intention,
l’hémostase
instrumentale
doit
cibler
les
saignements
osseux
et
veineux
par
stabilisation
temporaire
de
l’anneau
pelvien.
Elle
est
permise
par
des
moyens
divers
(fixation
externe,
C-Clamp
pelvien,
sangle
de
compression
pelvienne,
drapage
pelvien)
et
doit
être
réali-
sée
en
salle
de
déchocage.
La
persistance
d’une
instabilité
hémodynamique
après
stabilisation
temporaire
de
l’anneau
pelvien
indique
une
hémostase
instrumentale
de
sauvetage,
soit
par
un
packing

Traumatisme
du
pelvis
et
urgences
vasculaires
275
Instable
Catégorie
1
FAST
+
Radiogr
aphie du th
orax
et du bassin
Epanchement
péritonéal
Laparotomie
d'hémostase
Traumasme de
l'anneau
pelvien
ET
absence
d'épanc
hement
péritonéal
Stabilisaon de l'anneau pelvien
Pelvic
Bin
der
/
Fixateur ext
erne
/
C-
Clamp
Hémodynamiq
ue
stable
MDC
T
Saigne
ment
acf
artériel
ou
lésion
vasculaire
Syndrome
hémorr
agique?
Caractéri
sques du
saignement ac
f
artériel
au
scanner
Facteurs
favorisant le
saignement
Pas de
saignement
acf
artériel
ni lé
sion
vasculaire
Surveillance
Hémodynamique
Ins
tabl
e
AE
PPP
Stable
Catégor
ies
2
et
3
Scanner
Figure
1.
Prise
en
charge
du
traumatisé
de
l’anneau
pelvien.
AE
:
artério-embolisation
;
PPP
:
packing
prépéritonéal.
prépéritonéal
(PPP),
soit
par
une
artério-embolisation
(AE).
Ces
deux
méthodes
ne
s’opposent
pas.
Elle
sont
complémentaires
[28],
leur
place
dépendant
essentielle-
ment
des
habitudes
des
équipes.
Le
PPP
est
réalisable
rapidement
(en
15
minutes)
en
salle
de
déchocage,
après
stabilisation
de
l’anneau
pelvien.
Il
est
efficace
bien
que
n’agissant
pas
sur
les
saignements
arté-
riels
et
présente
une
morbidité
propre
(cicatrice,
sepsis,
syndrome
du
compartiment).
L’AE
a
tendance
à
être
considérée
dans
la
littérature
plus
comme
un
traitement
de
troisième
ligne
en
cas
d’échec
du
PPP,
que
comme
une
alternative
au
PPP.
Les
principaux
argu-
ments
avancés
concernent
la
durée
de
procédure
élevée
de
l’AE
(sans
qu’il
soit
cependant
rapporté
de
distinction
de
durée
entre
les
embolisations
sélectives
et
non
sélectives)
et
l’impossibilité
de
réaliser
un
geste
chirurgical
de
sauvetage
dans
une
salle
d’artériographie
(intérêt
des
salles
hybrides)
[28].
Certains
auteurs
rapportent
la
possibilité
de
réaliser
un
bilan
lésionnel
tomodensitométrique
(TDM)
chez
les
patients
avec
instabilité
hémodynamique,
sans
surmortalité,
lorsque
le
scanner
est
situé
en
salle
de
déchocage
[29,30].
La
place
de
l’AE
est
toujours
débattue
par
les
auteurs.
Certains
préconisent
une
AE
en
première
intention,
avant
mise
en
place
d’une
stabilisation
temporaire
de
l’anneau
pelvien
[31].
D’autres
considèrent
l’AE
prioritaire
sur
le
PPP
après
stabilisation
temporaire
de
l’anneau
pelvien.
Ces
décisions
relèvent
de
l’organisation
des
trauma-centers
(radiologues
et
orthopédistes
de
garde
ou
d’astreinte,
accès
permanent
ou
non
à
la
salle
d’angiographie).
Patients
sans
instabilité
hémodynamique
(catégorie
2
et
3)
Ils
relèvent
d’un
bilan
lésionnel
TDM
[10,32].
L’acquisition
doit
comporter
un
temps
artériel,
un
temps
veineux
et
éven-
tuellement
un
temps
tardif,
au
cas
par
cas.
Une
acquisition
sans
injection
de
produit
de
contraste
iodé
n’est
pas
néces-
saire
[33,34].
La
TDM
a
des
caractéristiques
intrinsèques
(sensibi-
lité,
spécificité,
valeurs
prédictives
positive
et
négative)
supérieures
aux
radiographies
pour
le
diagnostic
et
la
clas-
sification
des
traumatismes
du
pelvis.
La
TDM
permet
d’identifier
un
saignement
actif
ou
une
lésion
vasculaire
(sensibilité
:
66
à
90
%
et
spécifi-
cité
:
85
à
98
%
[35])
avant
l’apparition
d’une
défaillance
hémodynamique,
de
caractériser
les
lésions
pelviennes
associées
(épanchement
rétropéritonéal,
atteinte
viscérale
uro-génitale,
digestive)
et
les
lésions
extrapelviennes.

276
U.
Scemama
et
al.
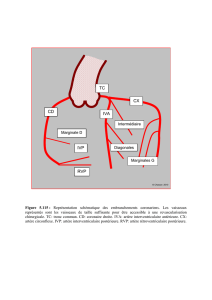
Figure
2.
Anatomie
artérielle
iliaque
interne
droite.
Fusion
de
reconstructions
VR
d’un
Cone-Beam
CT,
avec
injection
de
produit
de
contraste
dans
le
tronc
de
l’artère
iliaque
interne.
P1
:
artère
iliolombaire
;
P2
:
artère
glutéale
supérieure
;
P3
:
artère
sacrée
latérale
;
A1
:
artère
vésicale
supérieure
;
A2
:
artère
obturatrice
;
A3
:
artère
vésicale
inférieure
;
A4
:
artère
glutéale
inférieure
;
A5
:
artère
pudendale
interne
;
A6
:
artère
prostatique
;
A7
:
artère
rec-
tale
inférieure.
Il
existe
une
variante
de
distribution
des
branches
de
l’artère
iliaque
interne
:
l’artère
iliolombaire
naît
du
tronc
de
l’artère
iliaque
interne.
La
TDM
doit
être
réalisée
avant
l’AE.
Elle
guide
le
geste,
optimise
la
durée
de
scopie,
la
dose
rec¸ue
par
le
patient,
le
volume
de
produit
de
contraste
utilisé
pendant
le
geste
et
pourrait
même
diminuer
la
mortalité
[36].
Bilan
lésionnel
tomodensitométrique
:
ce
que
le
radiologue
doit
savoir
Anatomie
vasculaire
artérielle
du
pelvis
L’artère
iliaque
interne
assure
la
vascularisation
d’un
hémi-
pelvis.
Elle
donne
naissance
à
des
branches
viscérales
(artère
utérine,
artères
vésicales
supérieure
et
inférieure,
artères
rectales
moyenne
et
inférieure)
et
des
branches
pariétales
(artère
iliolombaire,
artère
sacrée
latérale,
artères
glutéales
supérieure
et
inférieure,
artère
obtura-
trice,
artère
pudendale
interne)
[37,38]
(Fig.
2).
La
distribution
est
variable.
Dans
la
majorité
des
cas,
on
distingue
un
tronc
commun
donnant
naissance
à
un
tronc
antérieur,
porteur
de
branches
viscérales
(artère
utérine,
artères
vésicales
supérieure
et
inférieure,
artères
rectales
moyenne
et
inférieure)
et
de
branches
pariétales
(artère
glutéale
inférieure,
artère
obturatrice,
artère
pudendale
interne)
et
un
tronc
postérieur
porteur
de
branches
parié-
tales
(artère
iliolombaire,
artère
sacrée
latérale,
artère
glutéale
supérieure).
Figure
3.
Anastomoses
artérielles
avec
le
territoire
iliaque
interne.
Reconstructions
VR
d’un
angioscanner
aortique.
a
:
inci-
dence
de
face.
Anastomoses
horizontales
avec
le
territoire
iliaque
interne
controlatéral
;
b
:
incidence
oblique
(45◦).
Anastomoses
verticales
avec
les
branches
de
l’aorte
(artère
lombaire,
artère
sacrée
médiane,
artère
mésentérique
inférieure)
et
les
branches
de
l’artère
iliaque
externe
(artère
épigastrique
inférieure,
artère
circonflexe
iliaque).
La
vascularisation
artérielle
du
pelvis
est
caractérisée
par
un
réseau
anastomotique
artériel,
artériolaire
et
pré-
capillaire.
Les
ligatures
unilatérale
ou
bilatérale
des
artères
iliaques
internes
ne
sont
ainsi
qu’à
l’origine
d’une
baisse
de
49
%
et
48
%
du
débit
artériel
en
aval
[39].
Il
existe
des
anastomoses
horizontales
(entre
les
deux
territoires
artériels
iliaques
internes)
et
des
anastomoses
verticales
(entre
des
branches
de
l’artère
iliaque
interne
et
des
branches
d’autres
territoires
artériels
:
branches
de
l’aorte
et
de
l’artère
iliaque
externe)
(Fig.
3).
On
peut
citer
les
anastomoses
entre
les
artères
gona-
diques
et
les
artères
utérines,
entre
les
artères
rectales
supérieures
(issues
de
l’artère
mésentérique
inférieure)
et
inférieures,
entre
les
artères
lombaires
et
les
artères
ilio-
lombaires,
entre
l’artère
sacrée
médiane
et
les
artères
sacrées
latérales,
entre
les
artères
pudentales
internes
et
externes,
entre
les
artères
obturatrices
et
les
artères
iliaques
externes.
L’artère
corona
mortis
caractérise
une
artère
obtura-
trice
issue
exclusivement
de
l’artère
iliaque
externe
ou
une
anastomose
entre
l’artère
iliaque
externe
et
l’artère
obtu-
ratrice
dans
le
canal
obturateur.
Il
s’agit
d’une
variante
anatomique
fréquente
(29
%
des
cas
de
Smith
[40]),
uni-
ou
bilatérale.
Les
saignements
ou
lésions
artérielles
rencontrées
dans
les
traumatismes
du
pelvis
intéressent
essentiellement
les
branches
de
l’artère
iliaque
interne.
Cependant,
une
par-
ticipation
de
branches
issues
de
l’aorte
(artères
lombaires
et
sacrée
médiane)
ou
de
l’artère
iliaque
externe
(artère
épigastrique
inférieure,
artère
corona
mortis,
artère
circon-
flexe
iliaque)
est
possible,
par
traumatisme
de
ces
artères
ou
de
leurs
anastomoses
avec
le
territoire
artériel
iliaque
interne.
Sémiologie
tomodensitométrique
des
saignements
actifs
et
des
lésions
vasculaires
Un
saignement
actif
artériel
est
caractérisé
par
une
extra-
vasation
de
produit
de
contraste
de
densité
au
moins
égale

Traumatisme
du
pelvis
et
urgences
vasculaires
277
Figure
4.
Sémiologie
TDM
des
saignements
actifs
et
des
lésions
vasculaires.
a
et
b
:
saignement
actif
artériel
(têtes
de
flèches)
en
territoire
pudendal
interne
;
c
et
d
:
saignement
actif
veineux
(têtes
de
flèches)
dans
le
territoire
glutéal
;
e
et
f
:
faux
anévrisme
(têtes
de
flèches)
dans
le
territoire
pudendal
interne
;
g
et
h
:
fragment
osseux
(têtes
de
flèches)
intramusculaire.
à
celle
de
la
lumière
aortique
au
temps
artériel,
de
volume
majoré
et
de
densité
supérieure
à
celle
de
la
lumière
aor-
tique
au
temps
veineux,
au
sein
d’un
épanchement
ou
d’un
hématome
rétropéritonéal
[41]
(Fig.
4).
Un
saignement
actif
veineux
est
caractérisé
par
une
extravasation
de
produit
de
contraste
au
temps
veineux,
non
visible
au
temps
artériel,
au
sein
d’un
épanchement
ou
d’un
hématome
rétropéritonéal.
Un
fragment
osseux
ne
présente
pas
de
modification
de
sa
forme
ni
de
sa
densité
sur
l’ensemble
des
acquisitions,
et
il
est
situé
à
proximité
d’une
fracture.
L’urine
opacifiée
extravésicale
n’est
visible
qu’en
cas
de
plaie
de
vessie,
au
temps
excrétoire
ou
en
cas
d’injection
rétrograde
de
produit
de
contraste
par
la
sonde
urétrale.
Un
faux
anévrisme
se
présente
sous
forme
d’une
image
d’addition
appendue
à
la
paroi
artérielle,
avec
une
cinétique
d’opacification
superposable
à
celle
des
artères.
Un
shunt
artério-veineux
réalise
une
opacification
pré-
coce
d’une
veine
au
temps
artériel.
Des
irrégularités
de
calibre
artérielles
peuvent
attester
d’un
spasme
ou
de
lésions
traumatiques
(dissection
avec
faux
chenal
non
circulant).
Un
arrêt
brutal
de
l’opacification
d’une
artère
atteste
d’une
lésion
artérielle
avec
une
occlu-
sion
de
la
lumière
par
un
thrombus,
et
peut
être
à
l’origine
d’un
saignement
retardé
par
mobilisation
du
thrombus.
Cartographie
tomodensitométrique
des
territoires
artériels
du
pelvis
L’identification
des
artères
porteuses
d’une
lésion
ou
d’un
saignement
actif
repose
sur
l’anatomie
du
trajet
des
branches
de
l’artère
hypogastrique.
L’utilisation
d’une
méthode
de
lecture
du
scanner,
décrite
par
Hallinan
et
al.,
distinguant
des
territoires
arté-
riels,
permet
de
s’affranchir
d’un
suivi
fastidieux
des
artères
et
constitue
un
gain
de
temps
pour
le
diagnostic
topogra-
phique
d’un
saignement
actif
ou
d’une
lésion
artérielle
[42]
(Fig.
5).
Indication
d’hémostase
instrumentale
L’identification
d’un
saignement
actif
artériel
ou
d’une
lésion
vasculaire
sur
le
bilan
lésionnel
TDM
indique
a
priori
une
AE.
Cependant,
certains
patients
présentant
un
saignement
actif
artériel
ou
une
lésion
vasculaire
ne
sont
pas
voués
à
l’exsanguination
[35].
La
décision
d’une
AE
est
multidisci-
plinaire
et
doit
intégrer
plusieurs
facteurs
:
•l’état
clinico-biologique
du
patient
:
présence
d’un
syndrome
hémorragique
—
choc
hémorragique
stabilisé,
tachycardie
supérieure
à
120
bpm,
hypotension
inférieure
à
90
mmHg,
élévation
des
lactates
sanguins,
baisse
de
la
réserve
alcaline
sanguine,
déglobulisation,
nécessité
d’un
remplissage
vasculaire
ou
d’une
transfusion
;
•les
caractéristiques
TDM
du
saignement
:
volume
de
l’extravasation
de
produit
de
contraste
;
évolution
du
volume
de
l’extravasation
entre
les
phases
artérielle,
por-
tale
et
tardive
;
topographie
du
saignement
actif
artériel
:
auto-tamponnable
ou
non
[41]
;
•les
facteurs
entretenant
le
saignement
:
liés
au
trauma-
tisme
(sites
et
nombre
de
saignements
ou
de
lésions
vasculaires),
aux
conséquences
du
traumatisme
(coagu-
lopathie
par
consommation,
hypothermie
et
acidose),
au
patient
(comorbidités,
traitements
antiagrégants
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%