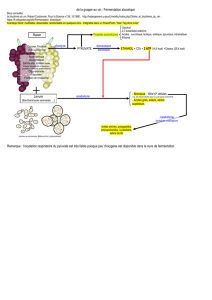
Dernier exemple de fermentation : une fermentation qui n’emprunte pas la voie de la
Glycolyse : La fermentation hétérolactique :
La glycolyse n’est pas la seule voie utilisée pour la fermentation, il existe aussi la voie des
pentoses phosphate (voie de Dichens et Horecker).
Certaines entérobactéries, des leuconostoc et quelques Lactobacillus peuvent effectuer cette
fermentation qui conduit à la formation de l’acide lactique, d’éthanol, d’acétate et de CO2.
Cette fermentation est mise en jeu dans la fabrication du kéfir (boisson à base de lait
fermenté, légèrement alcoolisée, produite au Moyen-Orient). Mais plus souvent elle conduit à
l’altération du vin, de la bière, des jus de fruits…
Elle possède en commun avec le shunt des hexoses phosphates, les réactions transformant
le glucose en pentose : ribose 5 phosphate et xylulose 5 phosphate.
Le xylulose 5 P est ensuite métabolisé différemment, il est scindé en :
- 1 composé en C3 : le 3 phosphoglycéraldéhyde qui est transformé en lactate
- 1 composé en C2 : l’acétylphosphate qui est transformé en éthanol
La fermentation hétérolactique produit du gaz (CO2), elle est moins acidifiante que la
fermentation homolactique.
Pour ce dernier exemple , il faut connaître le bilan de cette fermentation hétérolactique

2.4 Le catabolisme des autres glucides :
Les monosaccharides :
Certains peuvent intégrer directement l’une des voies du catabolisme du glucose que
l’on vient de voir , après avoir été phosphorylés.
C’est le cas du fructose (glycolyse) , du ribose et du xylulose( voie des pentoses
phosphate)
D’autres seront isomérisés en glucose grâce à l’action d’isomérase.
Exemple du galactose : (voie simplifiée)
UTP
Galactose + ATP Galactose-1-P UDP – galactose ------x Glucose 6 P
Les disaccharides : Les enzymes hydrolysant ces diosides sont presque toujours des
enzymes inductibles .C’est à dire que leur fabrication ne sera initiée par la bactérie (si elle en
posséde bien sur le gène) que si le substrat est présent dans le milieu de culture .
- La β fructosidase (saccharase ou invertine) hydrolyse le saccharose :
Saccharose Glucose + Fructose
- La β galactosidase hydrolyse le lactose :
Lactose Glucose + Galactose
- La maltase est une α1-4 glucosidase spécifique qui hydrolyse le maltose en 2
molécules de glucose.
Les polyosides : La plupart des micromycètes et quelques bactéries sont capables de
dégrader les polyosides en secrétant des enzymes hydrolytiques dans le milieu extérieur.
Ces produits de dégradation pourront ensuite entrer dans la bactérie et intégrer les
différentes voies métaboliques.
- L’amidon est dégradé par différentes amylases principalement en glucose et maltose.
- La cellulose est dégradé par des cellulases en glucose.
Hétérosides et dérivés d’oses : Des polyols comme le mannitol ou le sorbitol peuvent être
métabolisés dans le métabolisme glucidique.
Des hétérosides (comme l’acide hyaluronique présent dans les tissus conjonctifs) peuvent
être hydrolysés par des bactéries pathogènes responsables de gangrènes (Clostridium) ou
de suppurations (Staphylococcus aureus , Streptococcus pyogenes …).

2.5 Techniques d’étude au laboratoire :
L’identification des bactéries repose en grande partie sur l’étude des caractères
biochimiques . Ces caractères sont la traduction du métabolisme bactérien (notamment le
métabolisme glucidique) d’où
l’importance de son étude.
Etude de la voie d’attaque du glucose : On utilise les milieux Hugh et Leifson ou MEVAG
( en tube)pour déterminer si la bactérie fermente ou respire les sucres. Le principe général
de leur utilisation repose sur la production d’acides à partir des sucres ( en haut du tube car
présence d’oxygène pour la respiration , dans tout le tube en cas de fermentation). Ces
acides seront décelés par le changement de couleur d’un indicateur coloré de pH ( rouge de
phénol , bleu de bromothymol).
NB : La galerie API est également un outil utilisé pour déterminer cette voie d’attaque des
sucres , etude des fermentations (zymogramme sur API 20 E) , étude de l’assimilation des
sucres ( API 20 C AUX).
Milieu gélosé en boite permettant de visualiser la fermentation des sucres : Gélose lactosée
au BCP , Gélose DRIGALSKY , Gélose de CHAPMAN ….
Etudes particulières :
Utilisation de milieu complexe contenant plusieurs sucres (gélose kligler en tube
contenant du lactose et du glucose).
Recherche de l’utilisation du citrate sur gélose de citrate de Simmons ou galerie API
(présence du cycle de l’acide citrique = cycle de Krebs chez la bactérie).
Etude de la fermentation des acides mixtes et de la production de butane diol ( test
RM et VP).
Recherche de la Bgalactosidase par le test ONPG.
Comme ce test est particulièrement important , nous allons revoir le principe :
Une bactérie est capable d’assimiler lelactose (lactose+) si elle est capable de le faire entrer
(présence d’une B galactoside perméase) et si elle est capable de l’hydrolyser en glucose et
galactose (qui seront métabolisés selon les voies vues précédemment).

Le test ONPG a pour objectif de détecter la présence de l’enzyme Bgalactosidase chez les
bactéries lactose – ( puisque l’on vient de voir que les lactose + fabriquaient cette enzyme).
L’ONPG (OrthoNitroPhénolBGalactoside) est un analogue du lactose qui sera hydrolysé par
la Bgalactosidase en Galactoside et Orthonitrophénol de couleur jaune.
Les enzymes impliquées dans l’utilisation du lactose sont des enzymes inductibles , ce qui
signifie, qu’elles ne seront fabriquées par la bactérie qu’en présence de leur substrat c'est-à-
dire le lactose.
Rechercher la présence de B galactosidase chez une bactérie qui ne s’est pas développée
en présence de lactose est donc voué à un résultat négatif.
Le lactose est qualifié d’inducteur (il permet la fabrication de ces enzymes , cf opéron
lactose) et de Substrat (c’est la molécule subissant l’action de ces enzymes) .
L’ONPG n’est que le substrat de la Bgalactosidase , il ne permet pas d’en induire la
fabrication d’où la nécessité de faire cultiver la bactérie sur un milieu lactosé avant de
réaliser le test.
Technique
Le test se pratique uniquement chez les bactéries lactose - en 24 h sur milieu solide.
A partir : de Kligler ou milieu lactosé BCP ou CLED...
réaliser une suspension épaisse des bactéries testées en eau distillée.
ajouter avec une pince flambée mais refroidie un disque imprégné d’ONPG.
incuber 30 min à 37°C.
lire
Cupule de la galerie API 20 E ONPG -thio-galactoside
- Ensemencer avec la suspension d'une colonie en eau distillée (en général)
- Lecture identique à la technique classique
NB : Il n’est pas nécessaire de prélever une bactérie sur un milieu lactosé car on trouve dans cette
cupule e, en plus de l’ONPG , de l’IPTG qui est un inducteur de la B galactosidase.
Test ONPG -
Test ONPG +

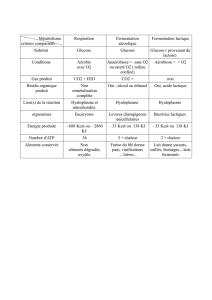
Résumé : Le métabolisme glucidique :
La dégradation d’un glucide s’accompagne d’une production d’acide visible par acidification
du milieu. Les différentes voies de ce métabolisme sont :
- La respiration : Le glucose est oxydé en CO2.
- La fermentation : Le glucose est oxydé en acides ou alcools.
Les différentes voies de dégradation :
De nombreux glucides peuvent être utilisés comme substrat. La plupart sont transformés en
glucose qui est dégradé, ensuite, en pyruvate, par la chaîne de la glycolyse.
Si le pyruvate est oxydé, il y a utilisation du cycle de Krebs : Pyruvate Acétyl
CoA 2 CO2 et énergie
Si le pyruvate est réduit, il y a fermentation en anaérobiose :
Homolactique : Glucose 2 Pyruvates Lactate
Alcoolique : Glucose 2 Pyruvates 2 éthanol + 2 CO2
Hétérolactique : Glucose-6-phosphates ribulose-5-phosphates éthanol et
lactate
Acide mixte : Glucose 2 Pyruvates succinate, éthanol, etc.…
Schéma général du métabolisme énergétique
(chimioorganotrophie)
Substrat organique réduit
SH2
Substrat organique oxydé
S
ATP (phosphorylation au niveau du substrat)
2 H+, 2 e-
(NADH,..)
Chaîne de transporteurs
d’électrons
ATP
(phosphorylation
oxydative)
RESPIRATION
2 H+, 2 e-
Accepteur final: O2
H2O
RESPIRATION
aérobie
NO2-+ H2O
RESPIRATION
anaérobie
Accepteur final: NO3-
(SO42-, fumarate)
Composés organiques
(endogènes)
Composés organiques réduits
FERMENTATION
 6
6
 7
7
 8
8
1
/
8
100%