Manuel de pathologie aviaire : Coccidioses des volailles
Telechargé par
eutamène ramzi

408 ●AUTRES MALADIES
Manuel de pathologie aviaire
Section IV
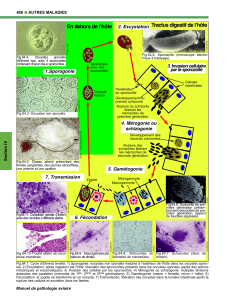
Fig.64.1: Cycle d'Eimeria tenella: 1) Sporogonie: oocystes non sporulés matures à l’extérieur de l'hôte dans les oocystes sporu-
lés; 2) Excystation: après ingestion par l'hôte, libération des sporozoïtes présents dans les oocystes sporulés (après des actions
mécaniques et enzymatiques); 3) Invasion des cellules par les sporozoïtes; 4) Mérogonie ou schizogonie: multiples divisions
asexuées des parasites (mérontes de 1ère, 2ème et 3ème générations); 5) Gamétogonie (macro = femelle, micro = mâle); 6)
Fécondation: le zygote se transforme en un oocyste; 7) Transmission: libération des oocystes dans la lumière intestinale après la
rupture des cellules et excrétion dans les fientes.
Fig.64.3: Oocystes non sporulés.
I Dinev - Ceva Santé animale
En dehors de l'hôte
Fig.64.2: Oiseau atteint présentant des
fientes sanglantes, des plumes ébouriffées,
une anémie et une apathie.
Fig.64.4: Oocystes sporulés
d'Eimeria spp. avec 4 sporocystes
contenant chacun deux sporozoïtes.
1.Sporogonie
V Guyonnet
Fig.64.5: Sporozoïte (microscope électro-
nique à balayage).
2. Excystation
Pénétration
du sporozoïte
Développement du
premier schizonte
Rupture du schizonte
libérant les
mérozoïtes de
première génération
Développement des
seconds schizontes
3. Invasion cellulaire
par le sporozoïte
4. Mérogonie ou
schizogonie
5. Gamétogonie
Rupture des
schizontes libérant
les mérozoïtes de
seconde génération
Microgamonte
Macrogamonte
6. Fécondation
Zygote
Oocyste
mature
Sporocyste
avec des
sporozoïtes
7. Transmission
V Guyonnet
V Guyonnet
Cellules
intestinales
Tractus digestif de lʼhôte
Fig.64.6: Schizonte de pre-
mière génération présen-
tant des mérozoïtes de pre-
mière génération (aspect
de faucilles aiguisées).
Fig.64.7: Schizontes (iléon de
dindon).
HJ Barnes AAAP
AAAP
Fig.64.11: Coccidiose cæcale (Dindon)
avec des coccidies à différents stades.
Fig.64.10: Poulet atteint de cocci-
diose intestinale.
Fig.64.8: Schizontes et
libération de mérozoïtes.
Fig.64.9: Macrogamétocyte
(cæcum de dinde).
HJ Barnes
HJ Barnes HJ Barnes

COCCIDIOSES ●409
Autres maladies
V Guyonnet
Chapitre 64
64. COCCIDIOSES
INTRODUCTION
Les coccidioses sont causées par diverses espèces
d'Eimeria affectant principalement le tractus digestif des
volailles. Du fait de la répartition mondiale de ces para-
sites, l'impact économique de cette maladie est estimé à
plus de 1 billion de dollars. Ce montant comprend la
diminution des productions et les pertes en animaux
ainsi que le coût des médicaments prophylactiques et des
vaccins. Il est généralement reconnu que l'industrie
aviaire n'aurait jamais autant progressé sans la décou-
verte dès le début des années 1950 d'anticoccidiens effi-
caces. La plupart des recherches sur les coccidioses
ayant été effectuées chez les poulets de chair et les repro-
ducteurs, les connaissances concernant les coccidioses
chez d'autres espèces comme la dinde, le canard, la pin-
tade, la caille ou le faisan sont plus limitées.
ÉTIOLOGIE & ÉPIDÉMIOLOGIE
Taxonomie
Les coccidies font partie de la famille des
Eimeriidae, groupe des protozoaires parasites intra-
cellulaires obligatoires. La structure de l'oocyste spo-
rulé permet la distinction entre Eimeria spp. et d'au-
tres parasites comme Cryptosporidium spp. Les
oocystes sporulés du genre Eimeria contiennent tou-
jours 4 sporocystes et chaque sporocyste 2 sporo-
zoïtes. Les Eimeria spp. sont extrêmement spéci-
fiques de leur espèce hôte, avec certaines espèces
n'affectant que les poulets et d'autres seulement les
dindes ou la pintade. Plusieurs espèces ont été iden-
tifiées chez la poule (7), la dinde (5), la caille (1), la
pintade (2), l'oie (4), le pigeon (2) et le faisan (4).
Cycle parasitaire d'Eimeria spp.
Sept phases distinctes ont été identifiées:
1) Sporogonie: Les oocystes éliminés dans les
fientes des sujets infectés peuvent rester dans les
litières pendant très longtemps. Grâce à des condi-
tions propices de température (15°C à 30°C) et d'hy-
grométrie, les oocystes vont sporuler dans les 48
heures, c'est-à-dire se transformer en structures
contenant 4 sporocystes, chacun contenant 2 sporo-
zoïtes. À ce stade, les oocystes sporulés sont prêts à
infecter un nouvel hôte après ingestion;
2) Excystation: libération des sporozoïtes impliquant à
la fois l'action mécanique du gésier et l'action enzyma-
tique du tube digestif (bile et enzymes protéolytiques
telles la trypsine, la chymotrypsine et les élastases).
3) Invasion cellulaire: Sitôt libres dans la lumière
intestinale, les sporozoïtes pénètrent dans les cellules
de l'épithélium intestinal ou cæcal, dans une zone
bien établie pour chaque espèce. À l'intérieur des cel-
lules, les sporozoïtes se transforment en trophozoïtes.
4) Mérogonie ou schizogonie: Durant ce stade, le
parasite (schizonte) se divise selon un processus de
division asexuée multiple, encore appelée mérogonie
(ou schizogonie) et chaque schizonte libérera, près
rupture cellulaire, plusieurs milliers de mérozoïtes.
La plupart de ces mérozoïtes vont à leur tour envahir
les cellules épithéliales voisines pour répéter ce pro-
cessus de multiplication. Selon les espèces d'Eimeria,
ce processus sera répété entre 2 à 4 fois avec l'inva-
sion de nouvelles cellules épithéliales.
5) Gamogonie: À un certain moment, les mérozoïtes
envahissent les cellules hôtes et se transforment en
gamétocytes, soit mâles, soit femelles. Les gaméto-
cytes mâles se multiplient par un processus de division
multiple asexuée et ces microgamètes sont libérés dans
la lumière intestinale. À l'inverse, le gamétocyte
femelle effectue sa maturation sans division cellulaire
en formant le macrogamète dans la cellule hôte.
6) Fécondation: Suite à la pénétration du gamète
mâle à l'intérieur du gamète femelle, une paroi
épaisse se forme autour du zygote et forme l'oocyste.
7) Transmission: Les oocystes (non sporulés) sont
libérés des cellules intestinales par rupture et excrétés
dans les fientes. Généralement, l'ingestion d'un
oocyste sporulé peut conduire à la production en 5 à 7
jours d'environ 2 à 3 millions de nouveaux oocystes.
Un certain nombre de facteurs, liés soit aux parasites
soit à l'hôte, affectent ce cycle parasitaire. En fonction
de l'espèce d'Eimeria, les parasites colonisent une
région particulière du tube digestif, avec une localisa-
tion plus ou moins superficielle. De plus, la durée de
la période prépatente (correspondant au temps écoulé
entre l'ingestion et l'excrétion d'oocystes) est spéci-
fique pour chaque espèce d'Eimeria. Il en est de
même pour la période nécessaire à la sporulation des
oocystes (sporogonie). Ces deux éléments constituent
une aide à l'identification de l'espèce d'Eimeria impli-
quée. Cependant la période prépatente peut être éga-
lement modifiée par une sélection génétique, comme
en témoignent les souches précoces (période prépa-
tente plus courte) développées en tant que souches
vaccinales. La spécificité des sites d'invasion peut
également être modifiée avec quelques espèces capa-
bles de se développer dans des œufs embryonnés (à
Manuel de pathologie aviaire

410 ●AUTRES MALADIES
Manuel de pathologie aviaire
Section IV
JM Répérant
Fig.64.12, 64.13, 64.14, 64.15. & 64.16: Taille comparée des oocystes de 5 espèces d'Eimeria spp.pathogènes pour le poulet.
Hôte Espèce Site de développement
Poulet Eimeria acervulina Intestin grêle (duodénum et le premier tiers)
Eimeria praecox Intestin grêle (duodénum)
Eimeria maxima Intestin grêle (vers le diverticule de Meckel)
Eimeria necatrix Intestin grêle (milieu), cæcum (oocystes)
Eimeria mitis Intestin grêle (seconde moitié)
Eimeria brunetti Intestin grêle (partie distale), gros intestin, rectum
Eimeria tenella Cæcum
Dindon Eimeria adenoides Cæcum, rectum
Eimeria gallopavonis Intestin grêle (partie distale), gros intestin, rectum
Eimeria meleagrimitis Intestin grêle (première moitié)
Eimeria meleagridis Cæcum
Eimeria dispersa Intestin grêle (partie moyenne)
Caille Eimeria bateri Intestin grêle
Pintade Eimeria grenieri Intestin grêle, cæcum (oocystes)
Eimeria numidae Intestin grêle, gros intestin
Oie Eimeria anseris Intestin grêle (parties moyenne et distale)
Eimeria fulva Intestin grêle (seconde moitié) et cæcum
Eimeria nocens Intestin grêle (seconde moité), cæcum et rectum
Eimeria truncata Rein
Pigeon Eimeria columbarum Intestin grêle (jéjunum et iléum)
Eimeria labbeana Intestin grêle
Faisan Eimeria colchici Intestin grêle (parties moyenne et distale), cæcum
Eimeria duodenalis Intestin grêle (duodenum)
Eimeria phasiani Intestin grêle et cæcum
Eimeria pacifica Cæcum
Tabl.64.1: Principales espèces d'Eimeria chez les volailles.
Eimeria spp, Période prépatente (h) Temps de sporulation (h) Taille des oocystes (µm)
Poulets
E. acervulina 97 17 18,3 x 14,6
E. maxima 121 30 30,5 x 20,7
E. necatrix 138 18 20,4 x 17,2
E. mitis 93 15 15,6 x 14,2
E. praecox 83 12 21,3 x 17,1
E. brunetti 120 18 24,6 x 18,8
E. tenella 115 18 22,0 x 19,0
Dindons
E. adenoides 103 24 25,6 x 16,6
E. gallopavonis 105 15 27,1 x 17,2
E. melagrimitis 103 18 19,2 x 16,3
E. meleagridis 110 24 24,4 x 18,1
E. dispersa 120 35 26,1 x 21,0
Tabl.64.2: Durées minimales de la période prépatente (temps écoulé entre l'ingestion des oocystes sporulés et la production
d'oocystes dans les fèces, exprimé en heures), et du temps de sporulation (temps nécessaire pour la transformation des
oocystes en oocystes sporulés infectants avec 4 sporocystes, chacun contenant deux sporozoïtes, exprimé en heures) et
dimensions des oocystes d'Eimeria spp. de la poule et de la dinde.
E. acervulina E. brunetti E. maxima E. necatrix E. tenella

COCCIDIOSES ●411
V Guyonnet
Chapitre 64
des fins de recherche uniquement) ou chez des hôtes
inhabituels. Le statut immunitaire de l'hôte joue aussi
un rôle déterminant dans le déroulement du cycle
biologique des coccidies.
Eimeria spp.: hôte et site d'invasion spécifique
L'une des caractéristiques des coccidies est leur
grande spécificité d'hôte. Les mécanismes impliqués
avec cette spécificité peuvent être liés à la nutrition et
à la biochimie des parasites, au profil génétique de
l'hôte ou à certains mécanismes de défense spéci-
fiques à l'hôte. La spécificité du site de l'infection est
une autre caractéristique de ces parasites, avec diffé-
rentes espèces envahissant des sites différents le long
du tube digestif. La répartition des sites d'invasion
est souvent suffisamment précise pour permettre
l'identification de l'espèce concernée lors de l'autop-
sie. Certaines espèces se développent le plus souvent
superficiellement dans les cellules épithéliales
(Eimeria praecox) tout au long de leur cycle parasi-
taire tandis que d'autres vont envahir les couches plus
profondes telles que les cellules des cryptes de
Lieberkühn et la lamina propria (Eimeria necatrix et
E. tenella).
IMMUNITÉ ANTICOCCIDIENNE
Cette immunité est marquée par une réduction de la
gravité des signes cliniques ainsi que d'une diminu-
tion de la production de parasites (oocystes). Dans
certains cas, la réduction des signes cliniques n'est pas
associée à une diminution des aspects lésionnels.
L'immunité anticoccidienne est soit innée du fait de la
stricte spécificité de l'hôte pour ces parasites, soit
acquise. L'immunité aquise est spécifique pour
chaque espèce de coccidie, cette spécificité pouvant
aussi exister en fonction des souches d'Eimeria acer-
vulina et d'E. maxima. Chaque espèce possède aussi
un caractère immunogène propre: E. maxima et E.
Praecox sont très immunogènes dès le premier cycle
parasitaire; au contraire, E. tenella (3-4 cycles) et E.
necatrix (4-5 cycles) le sont beaucoup moins.
L'immunité sera d'autant plus solide que l'hôte aura
été en contacts répétés avec les parasites, même s'il
s'agit d'oocystes en nombre très limité.
Les stades asexués de développement sont considé-
rés comme essentiels pour le développement de l'im-
munité, mais il existe des différences entre les
espèces. Chez un hôte présentant une immunité
solide contre la coccidiose, les oocystes sporulés
libèrent les sporozoïtes qui envahissent les cellules,
mais leur développement s'arrête après 24 à 48
heures. Lorsque l'immunité est moins établie, cer-
tains cycles de mérogonie et même la gamégonie
peuvent se produire. Les oocystes peuvent même être
libérés dans les fientes mais survivent moins long-
temps (la période patente est réduite). La durée de la
protection immunitaire dépend de l'espèce et la fré-
quence des réexpositions à de nouveaux parasites.
L'immunité anticoccodienne est essentiellement à
médiation cellulaire. Le stade initial est déclenché
lors de la reconnaissance par les cellules lymphocy-
taires des antigènes parasitaires à la surface des
macrophages. Le rôle des lymphocytes CD8+ est
complexe, impliquant à la fois une action directe via
la sécrétion de lymphokines ou de lymphotoxines et
une action indirecte par le recrutement des macro-
phages. Le rôle des macrophages et des cellules
tueuses (NK ou Natural Killer) est aussi important.
L'immunité humorale n'a qu'un rôle limité et il
n'existe pas de corrélation entre les taux plasmatiques
d'immunoglobulines et le degré de protection contre
les coccidioses. Seuls les anticorps sécrétoires IgA et
IgM semblent jouer un rôle au niveau de la barrière
intestinale en protégeant contre l'invasion des
cellules. En dépit de nombreuses recherches au
cours des 20 dernières années, les mécanismes de
l'immunité ne sont pas encore clairement établis.
Fig.64.18: La présence de fientes hémorragiques (E.
tenella sur la gauche), diarrhéiques ou mucoïdes (E.
acervulina sur la droite) alerte l'éleveur.
Fig.64.19: Avec des espèces
d’Eimeria moins pathogènes le
seul signe peut être un retard de
croissance.
JM Répérant
JM Répérant
I Dinev - Ceva Santé animale
JM Répérant
I Dinev - Ceva Santé animale
Fig.64.21: Eimeria dans les cellules
épithéliales intestinales (flèches).
Manuel de pathologie aviaire
Fig.64.20: Coccidiose. Aspect ané-
mié des organes internes.

412 ●AUTRES MALADIES
Manuel de pathologie aviaire
Section IV
Fig.64.22: E. acervu-
lina. Zone parasitée.
Zoetis
Fig.64.23 à 64.26: E. acervulina. Lésions le long de l'anse duodénale. Dans les cas graves, les lésions
s'étendent au jéjunum. Aspects typiques des zones blanchâtres, orientées transversalement (en échelle)
le long du duodénum (Fig.64.25). L'épaississement de la muqueuse intestinale observé est dû à l'agréga-
tion des gamétocytes et des oocystes (Fig.64.26).
MT Casaubon Huguenin
V Guyonnet
Fig.64.27: E. maxima.
Zone parasitée.
Zoetis
Fig.64.28 à 64.31: E. maxima. Mucus de teinte orangée caractéristique dans l’intestin. Pétéchies, notées 4 à
6 jours après l'ingestion des oocystes, présentes profondément dans la sous-muqueuse, sont mieux obser-
vées à la surface de la séreuse. Macrogamètes, zygotes et oocystes 6 jours après l’inoculation (Fig.64.31).
AAAP
AAAP
AAAP
V Guyonnet
Fig.64.32: E. tenella.
Zone parasitée.
Zoetis
Fig.64.33 à 64.36: E. tenella est la mieux connue des coccidies aviaires car les lésions sont facilement
reconnaissables et les pertes sont spectaculaires chez les poulets (Fig.64.33 & 64.34: poulets âgés de 7
semaines) ou les poulettes (Fig.64.35). Les lésions sont caractérisées par l'épaississement des parois du
cæcum et le sang visible dans le cæcum après ouverture (Fig.64.36).
I Dinev - Ceva Santé animale
HJ Barnes
HJ Barnes
HJ Barnes
HJ Barnes
HJ Barnes
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%






![III - 1 - Structure de [2-NH2-5-Cl-C5H3NH]H2PO4](http://s1.studylibfr.com/store/data/001350928_1-6336ead36171de9b56ffcacd7d3acd1d-300x300.png)



