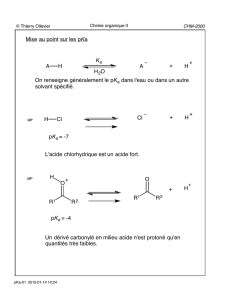
Acide acétique
Formule topologique et représentation 3D de
l'acide acétique
Identification
Nom UICPA acide acétique
Nom
systématique acide éthanoïque
Synonymes acide acétique glacial
acide éthylique, acide
méthanecarboxylique
No CAS 64-19-7
No ECHA 100.000.528
No CE 200-580-7
No RTECS AF1225000
Code ATC G01AD02 S02AA10
DrugBank DB03166
PubChem 176
ChEBI 15366

No E E260
FEMA 2006
SMILES
InChI
Apparence liquide incolore, d'odeur âcre et
fortement vinaigrée[1].
Propriétés chimiques
Formule
brute C2H4O2[Isomères]
Masse
molaire[5] 60,052±0,0025g/mol
C40%, H6,71%, O53,29%,
pKa 4,76 à 25°C[2]
Moment
dipolaire 1,70±0,03D[3]
Diamètre
moléculaire 0,442nm[4]
Propriétés physiques
T° fusion 16,64°C[6]
T° ébullition 117,9°C[6]
Solubilité Miscible avec l'eau, l'acétone,
l'alcool, le benzène, le glycérol,
l'éther, le tétrachlorure de

carbone; Pratiquement insol.
dans le disulfure de carbone[2]
Totalement miscible à
l'hexane, au toluène.
Paramètre de
solubilité δ 20,7MPa1/2 (25°C)[7];
18,9J1/2·cm-3/2 (25°C)[4];
12,4cal1/2·cm-3/2[8]
Masse
volumique 1,0492g·cm-3 (liquide,20°C)[6]
T° d'auto-
inflammation 465°C[10]
Point d’éclair 39°C (coupelle fermée)[1]
Limites
d’explosivité
dans l’air 5,4–16%vol[1]
Pression de
vapeur
saturante 1,5kPa à 20°C[1]
Viscosité
dynamique 1,22mPa·s à 25°C
Point critique 4,53MPa à 319,56°C[10]

Thermochimie
S0gaz, 1 bar 282,848J·mol-1·K-1[11]
S0liquide, 1 bar 158,0J·mol-1·K-1[11]
ΔfH0gaz -433kJ·mol-1[11]
ΔfH0liquide -483,52kJ·mol-1[11]
ΔfusH° 11,728kJ·mol-1 à 16,75°C[11]
ΔvapH° 23,7kJ·mol-1 à 117,95°C[11]
Cp123,1J·mol-1·K-1
(liquide,25°C)
63,44J·mol-1·K-1 (gaz,25°C)[11]
PCS 874,2kJ·mol-1[13] (liquide)
PCI -875,16kJ·mol-1[11]
Propriétés électroniques
1re énergie
d'ionisation 10,65±0,02eV (gaz)[14]
Cristallographie
Classe
cristalline ou
groupe
d’espace
Pna21 [15]
Paramètres
de maille a = 13,151Å
Å
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
1
/
61
100%