UNIVERSITÉ KASDI MERBAH DE OUARGLA
MASTER RESERVOIR ENGINEERING
COURS DE STIMULATION DES RESERVOIRS
--------------------------------------
ANNÉE SCOLAIRE 2016-2017

INTRODUCTION
L’exploitation d’un gisement d’hydrocarbures conduit inévitablement à une diminution de la production des
puits. Ce phénomène est provoqué soit par une déplétion naturelle ou par un endommagement de la couche
productrice, particulièrement aux abords du puits.
L’endommagement peut avoir plusieurs origines et se manifeste par une réduction de la perméabilité relative
à l’huile. Ce phénomène est le résultat du colmatage de la matrice par des dépôts de matières minérales et
organiques ou d’une inversion de la mouillabilité de la roche réservoir. Les différentes causes de
l’endommagement sont :
A- COLMATAGE
1- Durant la phase forage :
a- Broyage de la roche réservoir avec pulvérisation et compactage des particules entrainant une
obturation des canaux.
b- Pénétration des matières en suspensions des fluides de forage ou de complétion dans la
matrice.
c- Introduction du filtrat de la boue de forage ou du fluide de complétion dans la formation
pouvant entrainer l’apparition d’un Water block autour du puits ou une altération de la
mouillabilité de la roche réservoir.
d- Manœuvres brutales du train de sonde (effet de pistonnage en descente et dépression en
remontée).
2- Durant la phase complétion
a- Cimentation des cuvelages et leur restauration :
- Fracturation du terrain suite à une densité trop élevée du ciment ou à une manœuvre
brutale de la colonne.
- Le ciment peut provoquer les mêmes endommagements que les fluides de forage (dépôts
solides et water block).
b- Les fluides de complétion provoquent des endommagements identiques à ceux des boues de
forages. (dépôts, altération de la mouillabilité et water block)
c- Manœuvres brutales du matériel dans le puits
3- Durant la phase d’exploitation
a- Dépôts de matières minérales :
Sels solubles (chlorures), de sels peu solubles (sulfates et carbonates de calcium et magnésium
ainsi que les produits de la corrosion du fer des équipements).
Dépôts de sable, fines, plaquettes et fibres d’argile, silt, silicates, carbonates …
b- Dépôts de matières organiques.
Matières organiques dispersées dans l’huile de gisement. Elles sont constituées d’asphaltènes,
de paraffines, de résines et de cires. Ces matières ont un double effet : Elles réduisent les
dimensions des canaux et altèrent la mouillabilité des parois des pores et capillaires des roches
réservoirs.

Ces dépôts sont provoqués par une chute des paramètres thermodynamiques, température et
pression, par une variation de la salinité et un abaissement brutal du pH des effluents de la
formation.
4- Durant la stimulation des réservoirs
Les fluides utilisés lors de la stimulation peuvent provoquer des réactions secondaires avec les
constituants des roches réservoirs, les sels et les effluents du gisement. Aussi, des additifs mal
sélectionnés peuvent engendrer un colmatage des formations.
B- INSTALLATIONS MAL CONÇUES
1- Mauvais dimensionnement du tubing
2- Réseaux de collecte inadéquats en surface
3- Pression de séparation trop élevée. Dégazage mal réglé avec entrainement d’huile avec les gaz
torchés.
La stimulation :
La stimulation est une opération technique au cours de laquelle des moyens chimiques ou
mécaniques sont mis en œuvre afin de :
- restaurer la productivité du puits si celle-ci s’est réduite
- améliorer la productivité du puits qui était à l’origine mauvaise
Pour stimuler un réservoir différentes techniques sont utilisées.
1- Lavage à l’eau douce (dissolution des sels minéraux comme les chlorures)
2- Lavage au solvant aromatique (dissolution des asphaltènes, paraffines, résines et cires)
3- Acidification par HCl et HF (dissolution des sels peu solubles et des quartz – silicates)
4- Fracturation hydraulique (traitement profond de la matrice)
5- Fracturation à l’acide ( double effet de l’acide et fracturation )
--------------------------------------------------------------------------------------------
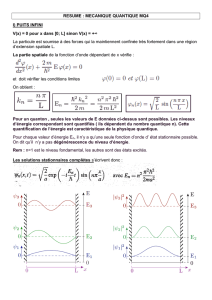
II- LES PHÉNOMÈNES CAPILLAIRES
A- LES FORCES INTERMOLÉCULAIRES

Pour une liaison entre deux atomes d'électronégativités différentes, il apparaît des charges partielles +δ et
-δ, rendant l'atome le plus électronégatif nucléophile et l'autre électrophile. Un atome nucléophile est un
composé chimique attiré par les espèces chargées positivement, par opposition à un composé électrophile.
Un dipôle électrostatique se définit par une répartition hétéroclite de charges électriques telles que
le barycentre des charges positives ne coïncide pas avec celui des charges négatives. Le dipôle le
plus simple est donc un couple de deux charges de signe opposé distantes d'une longueur a non nulle
quelconque.
Un dipôle peut être permanent, par exemple une molécule polaire, ou bien induit, par exemple un
nuage électronique qui se déforme sous l'action d'un champ extérieur (comme pour la diffusion )
Les forces intermoléculaires sont des forces de nature essentiellement électrostatique induisant une
attraction ou une répulsion entre des particules chimiques (atomes, molécules ou ions).
Dans ces forces intermoléculaires, on distingue :
1- Les forces de Van der Waals, de nature électrostatique, qui recouvrent plusieurs types d'interactions :
a- forces dipôle–dipôle ou forces de Keesom (effets d'orientation) ; Les forces de Keesom résultent
d'une interaction intermoléculaire entre dipôles permanents.
b- forces dipôle-induit dipôle ou forces de Debye, (effets d'induction) ; Les forces de Debye sont les
forces intermoléculaires résultants de l'interaction entre un dipôle permanent et un dipôle induit. Tous
les atomes et molécules sont polarisables ; cette polarisabilité résulte de la déformation du nuage
électronique due à la présence d'un champ électrique. Ce champ électrique peut être externe ou généré
par la molécule polaire.
c- forces instantanées dipôle-induit dipôle-induit ou forces de London (effets de dispersion) ; Les
forces de dispersion de London sont des forces faibles intermoléculaires créées par des dipôles induits.
Elles représentent en général la composante la plus importante des forces de Van der Waals. Les forces
de London existent du fait que la densité électronique des molécules est probabiliste : il y a une forte
chance à tout moment pour que celle-ci ne soit pas équitablement répartie à travers la molécule, ce qui
crée un léger moment dipolaire
d- forces ion–dipôle ;
2- Les liaisons hydrogène d'intensité plus élevée et de nature partiellement covalente ; La liaison hydrogène
ou pont hydrogène est une force intermoléculaire impliquant un atome d'hydrogène et un atome électronégatif
comme l'oxygène, l'azote et le fluor. L'intensité d'une liaison hydrogène est intermédiaire entre celle d'une
liaison covalente et celle des forces de van der Waals.
3- Les liaisons halogène : La liaison halogène (XB) est une liaison de nature proche de la liaison hydrogène (HB).
Elle s'établit entre les atomes d'halogènes électrodéficients (appauvris en densité électronique), facilement
polarisables tels que l'iode (I) et le brome (Br), et les entités riches en densité électronique comme les dérivés
azotés et oxygénés (amines, éthers, amides, etc). Les applications pratiques et potentielles de la liaison halogène
sont aussi vastes que celles de son analogue, la liaison hydrogène.

B- LA TENSION INTERFACIALE
Les deux schémas ci-dessus représentent les forces qui agissent sur les molécules
plongées dans un liquide, et sur celles qui sont au voisinage de sa surface libre
Les molécules se trouvant à la surface du liquide sont soumises à des forces intermoléculaires dissymétriques. Elles ont
une tendance à être attirées vers l’intérieure du liquide. Sur la surface du liquide, ces tensions sont
limitées à la demi sphère située sous la surface. Il s’ensuit que la résultante de ces
forces ne peut pas être nulle. Cette résultante est nécessairement dirigée vers le bas,
puisque (sauf s’il y a évaporation) le liquide ne s’échappe pas du récipient. Ce
phénomène se traduit par l’apparition d’une tension de surface caractéristique de
chacun des liquides. On peut dire qu’il se forme un film de molécules en surface qui
n’a pas plus tout à fait la même structure que celle que l’on retrouve au sein du
liquide
.
Appelée tension de surface ou énergie d'interface ou bien encore énergie de surface la tension superficielle
est une force qui existe au niveau de toute interface entre deux milieux différents (entre un solide ou un
liquide et un gaz). La tension entre des milieux identiques: deux solides, deux liquides, ou également entre
un liquide et un solide est généralement appelée: la tension interfaciale.
verre à ras bord avec la notion de capillarité
La tension superficielle est le travail nécessaire qu’il faut fournir pour augmenter la surface d’un corps d’une
unité de manière réversible.
L'unité de mesure de la tension superficielle est: N/m qui est équivalent aux (J/m2), erg/cm2 ou (dyne/cm).
On notera que la tension superficielle diminue lorsque la température augmente : cela s’explique par le fait que les
forces de cohésion intermoléculaires sont réduites par l’agitation thermique
C- MOUILLABILITÉ – ANGLE DE CONTACT
La Mouillabilité c’est l’aptitude de la surface d'un matériau à se laisser mouiller par les liquides; c’est aussi
la faculté pour une substance solide de recevoir un liquide en lui permettant de s'étaler sur la surface la plus
grande possible``
De façon générale, lorsqu'un liquide est mis en contact avec la surface d'un solide, il se forme un
angle de raccordement du premier sur le second. Lorsque le mouillage est parfait, l'angle de
raccordement devient nul. Dans ce cas l'énergie d'adhésion est maximum.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%