Immuno-
hématologie
Livret 4 d'activités technologiques
Chantal Muller (Professeur - Lycée La Martinière Duchère - LYON )
A+

Remerciements
Mes remerciements vont à tous ceux qui ont permis la réalisation de cet ouvrage, en particulier
certaines de mes collègues, professeurs au lycée La Martinière Duchère de Lyon avec qui j'ai travaillé
avec énormément de plaisir en immuno-hématologie :
Stéphanie Darmochod et Caroline Platroz qui
m'ont aidé à améliorer ces fiches techniques
ont réalisé de nombreux schémas (en particulier Stéphanie)
et ont relu l'ensemble des livrets.
Un remerciement aussi à Christiane Robin,
technicienne de laboratoire au lycée La Martinière Duchère de Lyon,
qui a contribué avec compétence et gentillesse à la mise au point de techniques.
Des remerciements aussi pour Gilles et Sangeetha Muller qui m'ont aidé pour la mise en page.

Avant-propos
Ce livret 4 d'activités technologiques s'adresse aux étudiants de première année de section de
technicien supérieur d'analyses de biologie médicale (B1ABM).
Il correspond au module 4 des activités technologiques d'hématologie du référentiel 2008 du brevet de
technicien supérieur d'analyses de biologie médicale.
Ce livret 4 fait partie de quatre livrets relatifs aux enseignements technologiques d'hématologie de la
section technicien supérieur d'analyses de biologie médicale.
Livret 1 – Cellules normales du sang et de la moelle rouge des os
Livret 2 – Hémopathies
Livret 3 – Hémostase
Livret 4 – Immuno-hématologie
MAI
MAI 2012
2012

Sommaire
Sommaire
Introduction à l'immuno-hématologie......................................................................................................... 5
Chapitre 1 – Groupes sanguins
Chapitre 1 – Groupes sanguins
Pré-requis et objectifs.................................................................................................................................
Détermination des groupes sanguins-Généralités .....................................................................................
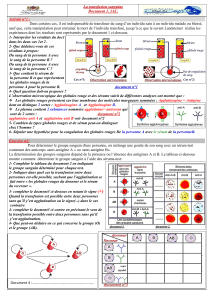
Fiche 1 – Détermination des groupes sanguins du système ABO ............................................................
Fiche 2 – Exercices: groupage ABO ........................................................................................................
Fiche 3 – Recherche de la substance H dans la salive..............................................................................
Fiche 4 – Groupage Rhésus standard........................................................................................................
Fiche 5 – Phénotypage Rhésus complet....................................................................................................
Fiche 6 – Détermination du groupe érythrocytaire dans le système Kell..................................................
Fiche 7 – Phénotype étendu.......................................................................................................................
7
8
11
18
21
23
31
37
41
Chapitre 2 – Anticorps irréguliers
Chapitre 2 – Anticorps irréguliers
Pré-requis et objectifs.................................................................................................................................
Fiche 1 – Recherches des anticorps irréguliers - Généralités ...................................................................
Fiche 2 – Test de Coombs indirect ...........................................................................................................
Fiche 3 – Test enzymatique à la papaïne...................................................................................................
Fiche 4 – Test de Coombs direct ...............................................................................................................
Fiche 5 – Procédure d'identification des anticorps irréguliers (AI) et exercices d'application..................
Fiche 6 – Titrage des anticorps irréguliers de type IgM.............................................................................
Fiche 7 – Titrage des anticorps irréguliers de type IgG.............................................................................
43
44
51
57
61
65
75
77
Chapitre 3 – Techniques en gel filtration
Chapitre 3 – Techniques en gel filtration
Généralités..................................................................................................................................................
Fiche 1 – Groupage ABO – RH1...............................................................................................................
Fiche 2 – Exercices – Interprétations de résultats obtenus en minigel.....................................................
79
81
83

Module 4 – Immuno-hématologie Activités technologiques
Introduction à l'immuno-
Introduction à l'immuno-
hématologie
hématologie
1 -
1 - Généralités
Généralités
L’immuno-hématologie correspond à l’étude :
- des antigènes portés par les éléments figurés du sang
- de l’immunisation qu’ils peuvent induire.
- des pathologies qui en résultent.
L'immuno-hématologie est donc une partie de la médecine commune à l'hématologie et à
l'immunologie.
Elle concerne l'étude:
–des groupes sanguins
–du système HLA
–des Ac irréguliers (RAI) mis en cause dans les les incompatibilités fœto-maternelles,
transfusionnelles
–d'auto-Ac formés lors de pathologies auto-immunes …
2 -
2 - Prélèvement sanguin
Prélèvement sanguin
Le sang est généralement prélevé sur EDTA ou sur citrate de sodium.
Un prélèvement sur tube sec ne permettra pas la réalisation de tests automatisés.
Les procédures qui concernent les groupes sanguins, et les examens immuno-hématologiques en
général, doivent être rigoureuses, en particulier pour ce qui concerne la prescription des examens et
l'identification des prélèvements.
ATTENTION : Deux déterminations du groupe sanguin sont nécessaires pour obtenir une carte de
groupe sanguin.
La législation précise : deux prélèvements effectués à des moments différents.
Étiquetage des tubes :
L'étiquetage des tubes doit se faire :
➔par la personne qui a prélevé,
➔immédiatement après le prélèvement,
➔sur le lieu du prélèvement,
➔en contrôlant l'identité du patient et en la lui faisant décliner chaque fois que cela est possible.
Les contrôles doivent être particulièrement vigilants chez les sujets comateux et les nouveaux-nés.
L'étiquette doit comporter les informations suivantes: nom du patient, nom de jeune fille, prénoms,
sexe et date de naissance.
B1ABM CM © 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
1
/
85
100%