Matière et états : Cours de chimie sur les mélanges et corps purs
Telechargé par
scacarlo

1DF
1.1 Vocabulaire à apprendre à maîtriser dans ce chapitre
La matière et ses états
matière masse état de la matière
solide liquide gaz ; gazeux
plasma
Les mélanges et leurs méthodes de séparation
mélange hétérogène
homogène alliage propriété (physique)
corps pur tamisage densité
masse volumique triage magnétique aimant
particules dissolution filtration
filtre filtrat centrifugation
centrifugeuse décantation miscible
non miscible entonnoir à robinet ou à décantation
soluble solvant solution
évaporation résidu précipitation
cristal/cristaux cristallisation distillation (fractionnée)
Les corps purs
transformation changement d’état fusion
solidification liquéfaction vaporisation
sublimation condensation ébullition
point d’ébullition point de fusion molécule
thermolyse/pyrolyse électrolyse élément chimique
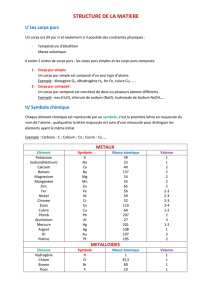
atome symbole tableau périodique
corps pur simple corps pur composé formule brute
1.2 Compétences à acquérir au cours de ce chapitre
A la fin de ce chapitre vous devrez être capable de
• Distinguer, l’un de l’autre, deux types de mélanges.
• Distinguer un mélange, d’un corps pur, d’un élément.
• D’associer chaque type de mélange avec ses méthodes de séparation.
• Décrire le principe de chaque méthode séparation.
• D’appliquer une méthode ou une succession de méthodes de séparation pour isoler le
ou les corps purs composant(s) un mélange.
• Reconnaître et d’interpréter le graphique d’une distillation.
• Définir ce qu’est un corps pur.

1DF
La matière dans tous ces états
2
• Citer les différents noms des changements d’état physique des corps purs.
• D’associer les noms des changements d’états des corps purs, aux états physiques
correspondants.
• D’associer les changements d’état physique des corps purs, aux représentations
graphiques correspondantes.
• Citer et décrire les différentes méthodes de décomposition des corps purs.
• Restituer la schématisation de la décomposition de l’eau par électrolyse
(démonstration).
• Différencier et définir les termes : évaporation, ébullition et vaporisation.
• Trouver, utiliser et changer les unités des constantes physico-chimiques des corps
purs, associées aux méthodes de séparation ou aux changements d’états, dans la
table CRM.
• Différencier et définir les termes : corps purs, molécule et éléments.
• Lire/décoder la formule brute d’une molécule.
• Identifier les corps purs simples et les corps purs composés d’après leur formule
brute.
• Représenter de façon simpliste (élément = disque) les molécules à partir de leur
formule brute.
1.3 La matière
La matière est tout ce qui occupe un espace. L’eau, la poussière de même
que les plantes, les animaux, les planètes du système solaire sont faits de
matière. Toute matière à une masse, c’est en quelque sorte la quantité de
matière (atomes et molécules) qui la constitue.
1.4 Les états de la matière
La matière peut prendre des formes très variées, mais elle se présente sous 4 états
principaux :
Sur la Terre : Solide (S) – Liquide (L) – Gaz (G)
Au cœur des étoiles: Plasma= fluide gazeux d’une température de 10'000'000°C.
Remarque : dans l’Univers, la plus grande partie de la matière se trouve à l’état
de plasma.
1.5 Les mélanges
La matière brute, telle que nous la trouvons dans la nature, se présente souvent sous forme
de mélanges de diverses substances
Un mélange
est formé de plusieurs constituants qui peuvent être solides, liquides ou gazeux
et qui conservent leurs propriétés.
L'observation des mélanges, à l’œil ou l'aide d'un microscope, permet de les classer en deux
catégories :

1DF
La matière dans tous ces états
3
A) Mélanges hétérogènes : au sein desquels, on peut distinguer, à l’œil ou à l'aide d'un
microscope, des parties ayant des aspects différents.
Exemples : sable, bois, béton, plante, eau naturelle non filtrée, sauce à salade, etc..
B) Mélanges homogènes : qui ont le même aspect (mêmes propriétés) en tous leurs points
et au sein desquels, il est impossible de discerner plusieurs constituants.
Exemples : eau salée ou sucrée (solutions), air, acier (alliages), vin, etc..
1.6 Les méthodes de séparation des constituants d’un mélange
La première étape de l’analyse de la matière consiste à séparer les mélanges pour obtenir
des corps purs, c’est-à-dire à « trier » les constituants du mélange selon leurs propriétés
physiques (aspect, taille, densité, température d’ébullition …) sans changer la nature
chimique de la substance.
Le choix de la méthode de séparation va dépendre de la nature hétérogène ou homogène du
mélange. Nous décrivons ici quelques méthodes de séparation utilisées fréquemment au
laboratoire (voir expériences).
1.6.1 Séparation des mélanges hétérogènes
1.6.1.1 Mélange Solide-Solide
Le tamisage
Le tamisage permet de séparer des solides dont
les particules sont de dimensions différentes. Si les
particules des divers constituants sont de densités
différentes, elles peuvent être séparées soit par un
courant d’air (ventilation), soit par un courant d’eau
(lévigation ou flottation).
Le triage magnétique
Si l’un des solides contient du fer, on pourra le
séparer à l’aide d’un aimant.
La dissolution :
Enfin, si l’un des constituants est
soluble dans l’eau ou un autre
liquide, on effectuera la séparation
par dissolution du constituant
soluble dans le liquide (solvant)
approprié.
solide
Ajouter de l’eau
au solide
Agiter Le solide est
dissout, on a une
jouter de l’eau

1DF
La matière dans tous ces états
4
1.6.1.2 Mélange Liquide-Solide
La filtration
La filtration permet de séparer facilement le liquide et
les particules solides. Le mélange est versé sur un
filtre (papier ou une autre matière) qui laisse passer
le liquide (filtrat) et retient les particules solides.
La filtration sous vide permet de séparer les solides
des liquides plus rapidement et efficacement que la
filtration classique.
Filtration sous vide (Büchner)
Une pompe à vide aspire l’air présent dans
l’erlenmeyer induisant une différence de pression
entre l’extérieur et l’intérieur de l’erlenmeyer. Ceci
permet d’aspirer le mélange au travers du papier
filtre posé au fond du Büchner et
ainsi séparer le solide du liquide.Le
solide (résidu de filtration) qui reste
sur le papier filtre se retrouve plus
sec et peut être facilement
récupéré.
La décantation
Dans la majorité des cas, si on
laisse reposer un mélange
solide-liquide, la séparation se
fait spontanément car les
particules solides se déposent
au fond du récipient. Une fois
les particules solides
déposées, on peut prélever le
liquide, qui surmonte le dépôt
solide. On dit alors que l’on
décante.
La centrifugation
Lorsque la décantation ou la
filtration sont difficiles à réaliser,
la technique la plus simple pour
séparer un mélange solide-
liquide est la centrifugation.
Les centrifugeuses sont des
appareils comprenant un
moteur permettant de soumettre
à un mouvement de rotation
rapide, autour d'un axe, des tubes à centrifuger contenant le mélange à séparer. Le dépôt de
la phase solide est considérablement accéléré sous l'action de la force centrifuge (100 à
1000 fois plus grande que celle due à la pesanteur).
Entonnoir
Büchner
Joint conique
pour l’étanchéité
Erlenmeyer à
vide
POMPE A
VIDE
Papier filtre

1DF
La matière dans tous ces états
5
1.6.1.3 Mélange de plusieurs liquides non miscibles
Des liquides non-miscibles sont des liquides qui ne se
mélangent pas, comme l’eau et l’huile.
Si on laisse au repos, dans un entonnoir à robinet (voir
image ci-contre) un mélange de plusieurs liquides non-
miscibles, on obtient généralement une séparation de
ces liquides. Ceux-ci se répartissent dans le récipient en
couches superposées, en fonction de leur masse
volumique. Le liquide ayant la masse volumique la plus
grande se trouve toujours dans la couche la plus basse.
On peut alors facilement séparer les diverses couches à
l’aide du robinet
1.6.2 Séparation des mélanges homogènes
La séparation des mélanges homogènes s’effectue par des méthodes spécifiques
nécessitant souvent de l’énergie sous forme de chaleur.
1.6.2.1 Les solutions
Une solution est un ou plusieurs solide(s),
gaz ou liquide(s) qui est(sont) dissout(s)
dans un liquide.
L’évaporation
L’évaporation est utilisée lorsque la solution
est composée d’un solide dissout dans un
liquide. Si le liquide de la solution est volatil,
l’eau, l’alcool par exemple, on élimine le
liquide en chauffant la solution. On peut ainsi
recueillir le corps solide, résidu de
l’évaporation totale du liquide. Dans cette
opération, le liquide de la solution est perdu.
On peut aussi effectuer une évaporation
partielle du liquide. Lors de cette opération,
on arrête l’évaporation du liquide lorsque le solide ne peut plus rester dissout dans le liquide
(on parle de solution saturée).
Le solide se séparera du liquide de lui-même sous forme d’une poudre, c’est la
précipitation ou sous forme de cristaux: c’est la cristallisation.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%