Fiches de Révision Chimie Bac 2018 : Tableau d'Avancement
Telechargé par
ammariyassine

BAC 2018
Copyright ©
FICHES DE REVISION
Page 1 sur 36 WWW.TUNISCHOOL.COM CHERCHARI
LE TABLEAU D’AVANCEMENT
Équation chimique
aA + bB → cC + dD
États du système
Avancement
Quantités de matière correspondantes
État initial (à t=0)
0
n(A)i
n(B)i
n(C)i
n(D)i
En cours de transformation (t>0)
X
n(A)i – ax
n(B)i – bx
n(C)i + cx
n(D)i + dx
État final (à t=0)
xf
n(A)i – axf
n(B)i – bxf
n(C)i + cxf
n(D)i + dxf
Si la réaction directe est possible spontanément :
i
1
i1 2 max 1
ii
2
n(A)
x
n(A) ax 0 asi x x x x et A est le réactif limitant
ou n(B) bx 0 n(B)
ou x b
Autre méthode :
ii
n(A) n(B)
si A est le réactif limitant et B est le réactif en excés.
ab
Exemple : pour la réaction d’équation 2I- + S2O82- I2 + 2 SO42- si on nous donne l’un des graphes suivants :
n(I2) = x donc xf = nf(I2) = 4.10-4 mol dans cet exemple.
Dans cet exemple n0(I-) =16.10-4 mol et nf(I-) = 8.10-4 mol
Or nf(I-) = n0(I-) – 2xf on peut ainsi déterminer xf.
L’AVANCEMENT VOLUMIQUE Y
X
Y avec V : volume du système chimique.
V
y est en mol.L-1.
n(I2)
16

BAC 2018
Copyright ©
FICHES DE REVISION
Page 2 sur 36 WWW.TUNISCHOOL.COM CHERCHARI
LA CINETIQUE CHIMIQUE
LA VITESSE MOYENNE D’UNE REACTION CHIMIQUE :
Définition : est la variation par unité de temps de l’avancement pendant une durée donnée .
21
21
( ) ( )
moy x t x t
vtt
Unité de la vitesse d’une réaction chimique est mol.(unité de temps)-1
Attention : Si le graphe donné ne représente pas x en fonction du temps, il faut déterminer l’expression de x à partir du
graphe donné puis calculer x aux instants donnés ( n’oublier pas que x(t=0)=0 ).
Exemple : on nous donne la réaction d’équation 2I- + S2O82- I2 + 2 SO42- et le graphe de n(I-)=f(t) , on doit tout
d’abord détermine x(t). on a n(I-)t = n0(I-) -2x 2x = n0(I-) – n(I-)t
0t
n (I ) n (I )
x(t) 2
puis on calcule la vitesse
moyenne.
LA VITESSE INSTANTANEE D’UNE REACTION CHIMIQUE :
Définition : est la dérivée par rapport au temps de l’avancement.
dx
vdt
Attention :
* Si on a le graphe de x=f(t) v=pente de la tangente à la courbe à l’instant voulu.
* Si on a le graphe de n(réactif)=f(t)
11
1 dn(réactif) 1
v(t ) .pente de la tangente à la courbe à t .
coeff.stockio dt coeff.stockio
* Si on a le graphe de n(produit)=f(t)
11
1 dn(produit) 1
v(t ) .pente de la tangente à la courbe à t .
coeff.stockio dt coeff.stockio
Exemple :
on nous donne la réaction d’équation 2I- + S2O82- I2 + 2 SO42- et le graphe de n(I-)=f(t) , on a n(I-)t = n0(I-) -2x si on
dérive cette relation :
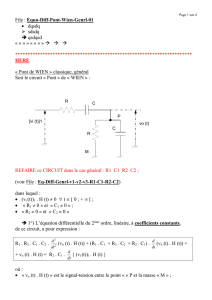
dn(I ) dx 1
0 2. pente de la tangente 2.v(t) v(t) .pente de la tangente.
dt dt 2
LA VITESSE VOLUMIQUE D’UNE REACTION CHIMIQUE :
11
VOL v(t)
V (t) sonunité mol.L .(unité de temps)
Volume
LES FACTEURS CINETIQUES :
si elle augmente la réactionest plus rapide.
* Concentration des réactifs si elle diminue la réactionest plus lente.
si elle augmente la réactionest plus rapide.
* Température si elle diminue la réactionest plus lente.
* Catalyse
ur, s'il est présent la réactionest plus rapide.
Attention :
Lorsqu’une réaction chimique se produit sans intervention du milieu extérieur, sa vitesse diminue au cours du temps à
cause de la diminution de la concentration des réactifs.

BAC 2018
Copyright ©
FICHES DE REVISION
Page 3 sur 36 WWW.TUNISCHOOL.COM CHERCHARI
ESTERIFICATION HYDROLYSE
Équation générale de l’estérification : RCOOH + R’OH RCOOR’ + H2O
Donner le nom de chacun des esters suivants :
HCOOC2H5
CH3COOCH3
CH3COOC2H5
Méthanoate d’éthyle
Éthanoate de méthyle
Éthanoate d’éthyle
Les caractères de la réaction sont : lente, limitée et athermique
Le catalyseur de l’estérification est : acide sulfurique concentré
Lors du dosage de la quantité d’acide restante au cours de la réaction d’estérification, l’équivalence acido-basique
est atteinte lorsque n(ac)t = nb n(ac)0 – x =CbVb. x=n(ester)t=n(ac)0 – CbVb.
La fonction des concentrations relative à l’estérification :
..
.
.
ester eau
ester eau
acide alcool acide alcool
nn
Ester Eau nn
VV
nn
Acide Alcool n n
VV
Loi d’action de masse : à l’équilibre dynamique =K ; K constante d’équilibre (K=cte >0 toujours) qui ne dépend que
de la température.
: l’estérification est une réaction athermique K ne varie pas lorsque la température varie donc Remarque
4'
2,25 ' sec .1
K si l alcool est primaire
K si l alcool est ondaire esterification hydrolyse
Attention K K
Conditions d’évolution spontanée de la réaction :
tan
tan
K la réaction directe est possible spon èment
K la réaction inverse est possible spon èment
Attention : La variation de la température n’a aucun effet sur l’équilibre du système chimique ( sur la composition du
système à l’équilibre dynamique ) car la réaction est athermique.
Dans le cas de l’estérification, la variation de température a seulement un effet cinétique sur la réaction, mais elle est sans
effet sur l’équilibre du système.

BAC 2018
Copyright ©
FICHES DE REVISION
Page 4 sur 36 WWW.TUNISCHOOL.COM CHERCHARI
EQUILIBRE CHIMIQUE – LOI DE MODERATION
La fonction des concentrations
Pour l’équation chimique : aA + bB cC + dD ; la fonction des concentrations :
cd
ab
CD
AB
La fonction usuelle des concentrations, si l’un des constituants du système chimique est un :
()
()
( ).
1
'exp
liquide pur lq ou
solide pur sd ou
solvant ou
graphite gr
sa concentration molaire est remplacée par
dans l ression de
Exemple : Pour l’équation Cu2+ + 2OH- Cu(OH)2 (sd) ;
2
2
1
Cu OH
Loi d’action de masse : à l’équilibre dynamique =K ; K constante d’équilibre (K=cte >0 toujours) qui ne
dépend que de la température.
Conditions d’évolution spontanée de la réaction :
tan
tan
K la réaction directe est possible spon èment
K la réactioninverse est possible spon èment
Remarque importante : K est indépendante de la composition molaire initiale du système chimique tandis que f varie
lorsqu’on modifie cette composition initiale.
Loi de modération :
Les facteurs d’équilibre :
*'
* ( )
* ( ' )
La concentration de l un des constituants affecte
La pression si le système renferme au moins un gaz affecte
La température si la réaction n est pas athermique affecte K
Énoncé de la loi de modération : Si dans un système chimique initialement en équilibre, une perturbation
fait varier
tan ;
tan ;
' tan .
soit latempérature à pression cons te pour un système fermé
soit la pression à température cons te pour un système fermé
soit la concentration d une entité chimique à température cons te pour un système ouvert
La réaction évolue dans le sens qui tend à modérer la variation du facteur d’équilibre.

BAC 2018
Copyright ©
FICHES DE REVISION
Page 5 sur 36 WWW.TUNISCHOOL.COM CHERCHARI
LES FORCES COMPAREES DES ACIDES ET DES BASES
Acide fort - acide faible et base forte - base faible :
Le taux d’avancement final de la réaction de dissociation dans l’eau d’un(e) :
10
:
10
:
pH
f
pH pKe
f
acide C
base C
Un acide ou une base est fort(e) si
f =1
Un acide ou une base est faible si
f <1.
Constante d’acidité Ka et constante de basicité Kb :
La constante d’acidité d’un couple acide/base AH/A- est
33
.
a
Forme basique H O A H O
KForme acide AH
.
La constante de basicité d’un couple acide/base AH/A- est
.
b
Forme acide OH AH OH
KFormebasique A
Ka.Kb = [H3O+].[OH-] = Ke.
pKa pKb
a a a b b b a b
pK logK et K 10 et pK logK et K 10 enfin pK pK pKe
Comparaison des forces des acides entre eux et des bases entre elles :
Cas des acides :
L’acide le plus fort est celui qui a le pKa le plus petit
À même concentration, l’acide le plus fort est celui qui a le pH le plus petit
À même pH, l’acide le plus fort est celui qui a la concentration molaire la plus petite
Remarque : si suite à une dilution, la quantité de matière d’ions H3O+ ne varie pas, l’acide est fort.
Cas des bases :
La base la plus forte est celle qui a le pKa le plus grand
À même concentration, la base la plus forte est celle qui a le pH le plus grand
À même pH, la base la plus forte est celle qui a la concentration molaire la plus petite
Remarque : si suite à une dilution, la quantité de matière d’ions OH- ne varie pas, la base est forte.
Attention :
Suite à une dilution d’une solution d’acide (ou basique ) le pKa ne varie pas ( car le pKa d’un couple acide-base ne dépend
que de la température) : donc suite à une dilution, le caractère d’un acide ( ou d’une base ) ne varie pas s’il est fort il reste fort
et s’il est faible il reste faible.
Suite à une dilution d’une solution d’acide faible (ou de base faible )
f augmente : la dilution favorise l’ionisation d’un
acide faible ( ou d’une base faible).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%