document prof sur l'aspect quantitatif de l'équilibre chimique
Telechargé par
stephaniejoine

Mode de lecture du document
Lorsqu’il s’agit d’une indication pour moi en tant qu’enseignante, la plupart du temps des
questions que je pose oralement, le texte est dans une police différente, encadré et dispose à
sa gauche du dessin d’un enseignant
En orange se trouvent les réponses aux questions pour les élèves. Elles ne sont pas présentes
dans le document élève

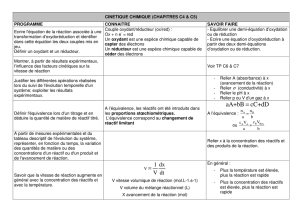
L’équilibre chimique : approche quantitative
1) Introduction : Rappel
Fait oralement et au tableau
Quels types de réactions avons-nous déjà vues ?
Définissez une réaction incomplète
À quoi ressemblerait un graphique du nombre de moles de réactifs en fonction du temps pour
une réaction incomplète ?
Est-ce pour cela que plus rien ne se passe dans le récipient où se trouvent les réactifs et
produits ?
Qu’est ce qui caractérise ce type de réaction ?
Comment prévoir qu’une réaction sera équilibrée ?
Il existe des réactions qui sont dites complètes, incomplètes et impossible.
Au cours d’une réaction incomplète, aucun réactif ne réagit complètement. Le
nombre de moles de réactifs au cours du temps n’atteindra donc jamais une valeur
nulle :
De boeck
Ces réactions incomplètes sont aussi appelées des réactions à l’équilibre :
- Les propriétés macroscopiques restent constantes
- Pour rester à l’équilibre, le système doit être isolé
- En réalité, microscopiquement, deux réactions inverses se déroulent à
vitesse égale. C’est pourquoi on appelle ce système un système chimique à
l’état d’équilibre dynamique
Rappel de la vidéo au niveau microscopique
introducing-chemical-equilibrium-englishgood.mp4
Deux facteurs permettent de déterminer le type de réaction :
-

2) Mise en situation : l’hémoglobine
Idée issue de « http://www.enseignons.be/upload/secondaire/chimie/chimie-5e-1h-equilibre-reactionnel-version-
eleve.doc » et « testmonlab.weebly.com/uploads/8/4/3/5/.../chapitre_3_preuve_2_sol.pdf »
http://nanotechnologies.tpe.free.fr/nanorobots.html
Lorsque nous respirons, de l’air entre dans nos poumons et passe dans les capillaires afin de rentrer
en contact avec les globules rouges du sang. Ces globules rouges contiennent de l’hémoglobine (Hb)
qui va réagir avec cet oxygène (O2) pour le fixer selon cette réaction :
Hb + O2 → HbO2
(En réalité, l’hémoglobine peut charger 4 oxygènes)
Question : L’équation est-elle pondérée correctement ? Oui
Lorsque l’hémoglobine chargée en oxygène arrive au niveau des tissus, elle va donner à ceux-ci son
oxygène selon la réaction :
HbO2 → Hb + O2
Nous voyons ainsi que la réaction de l’oxygène avec l’hémoglobine est une réaction réversible que l’on
peut écrire :
Le système hémoglobine-oxygène est en réalité un système à l’équilibre :
La réaction HbO2 → Hb + O2 se fait à la même vitesse que la réaction Hb + O2→ HbO2
Rappel : Question : Que signifient les deux flèches de même longueur mais de sens différent ?
→ Cela signifie que les deux réactions se déroulent en même temps, dans des sens opposés
et à la même vitesse

Ce système va donc tout faire pour maintenir cet équilibre. Donc, si la concentration d’un réactif ou
d’un produit est modifiée, la réaction va évoluer afin de retrouver son état d’équilibre.
Dans une réaction à l’équilibre, la constante d’équilibre K décrit les concentrations de réactifs et de
produits.
Lorsque le K de la réaction est élevé, la concentration en produit est plus importante
que la concentration en réactifs
[Réactifs] < [Produits]
L’équilibre est dans ce cas déplacé vers la droite, vers les produits
Lorsque le K de la réaction est faible, la concentration, en réactif est plus importante
que la concentration en produit
[Réactifs] > [Produits]
L’équilibre est dans ce cas déplacé vers la gauche, vers les réactifs
Il y a bien toujours ici un équilibre ! Voici une métaphore intéressante :
http://sciences-chouvin.jimdo.com/ts-ancien/chimie/chimie-5-l-équilibre-chimique/
Deux îles sont séparées par un pont. Le nombre de voiture sur un même temps qui part de Clio pour
aller vers Calipso est égal au nombre de voitures qui part de Calipso pour aller vers Clio. (la vitesse de
départ de Clio vers Calipso est donc la même que celle des départ de Calipso vers Clio)
Y-a-t-il bien un état d’équilibre ?
Oui
Cet équilibre est-il dynamique ?
Oui, les voitures vont dans les deux sens
Cela signifie-t-il pour autant que le nombre de voiture sur chaque île est le même ?
Non, il peut y
avoir plus de voiture à Clio par exemple. Mais ce nombre restera constant car le nombre de voiture qui
part de Clio est égal au nombre de voiture qui va à Clio.
Parallèle palliant à la difficulté des élèves de visualiser l’aspect dynamique de l’équilibre

Situation 1 : dans les poumons
http://fr.dreamstime.com/photos-libres-de-droits-structure-d-h%C3%A9moglobine-humaine-image34873928
Lorsque les globules rouges arrivent au niveau des poumons qui sont chargés en oxygène, le
système détecte une augmentation de la concentration en un réactif, l’O2. La réaction va alors
être déplacée vers la droite, c’est-à-dire que l’hémoglobine réagit donc avec l’oxygène pour
former HbO2.
testmonlab.weebly.com/uploads/8/4/3/5/.../chapitre_3_preuve_2_sol.pdf
Situation 2 : dans les tissus
http://doc.doc.pagesperso-orange.fr/physio.htm
Les tissus sont des zones pauvres en oxygène puisqu’ils l’ont utilisé. Le système détecte donc
une diminution de la concentration en un réactif, l’oxygène. La réaction va alors être déplacée
vers la gauche c’est-à-dire que l’hémoglobine chargée en oxygène va se transformer en Hb +
O2.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%