Révision STE chapitre 3 1. La masse des réactifs est toujours égale

Christian Tremblay
Révision STE chapitre 3
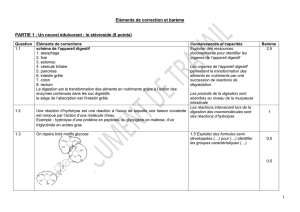
1. La masse des réactifs est toujours égale à la masse des
produits. Il en va de même pour le nombre d’atomes.
2. 12 g
3. a. Appliquer la loi de la conservation de la matière à
une équation chimique en changeant les coefficients
devant les particules
b. Une équation qui n’est pas balancée
c. Le chiffre qui est placé devant les particules. Il
représente un nombre de moles
4. a.
b.
c.
d.
5. a. Proportion entre les nombres de moles des réactifs et
le nombre de moles des produits
b. Connaitre la quantité de réactifs utilisés ou connaitre
la quantité de produits formés
6. 1,333333 moles
7. a. 80 g
b. 8 moles
8. a. La liaison ionique est un don d’électron de la part du
métal vers un non-métal et la liaison covalente est un
partage d’électrons entre non métal ou entre deux
atomes d’un même élément.
b. La capacité d’un élément à attirer les électrons. La
propriété qui détermine le type de liaison chimique
entre deux atomes. Si la différence
d’électronégativité est grande entre deux particules,

Christian Tremblay
ce sera une liaison ionique et si la différence est
petite, ce sera une liaison covalente
c. Un composé issu d’une liaison ionique
9. Métal et non-métal
10. a. CaCl2, LiF, CaCO3, FeSO4
b.
11. a. Permettre de nommer les éléments et les molécules
chimiques
b. La façon d’écrire en formule chimique des molécules
12. a. Chlorure de césium
b. Fluorure d’argent
c. CBr4
d. Dinitrate de calcium
e. SCl6
f. SrCl2 / Dichlorure de strontium
g. AlCl3 / Trichlorure d’aluminium
13. a. Processus chimique où un acide et une base
réagissent ensemble afin de former un sel et de l’eau
b. Parce que l’on peut autant neutraliser une base par un
acide qu’un acide par une base

Christian Tremblay
14. a. Le pH augmentera, car les ions H+ et OH- réagiront
ensemble afin de former de l’eau. Tant et aussi
longtemps que ces deux quantités ne seront pas
équivalente en solution, le pH sera différent de 7.
b.
c. Il sera supérieur à 7
15. a. Lorsque deux particules simples s’associent afin de
donner un produit plus complexe
b. C’est l’inverse de la synthèse. Une molécule plus
complexe qui se dissocie en molécules plus simples
c. Lorsque deux substances en solution réagissent
ensemble et qu’ils produisent ensemble un produit
solide
16. a. Décomposition
b. Précipitation
c. Synthèse
17. a. Une réaction endothermique absorbe de l’énergie du
milieu pour produire des liaisons chimiques tandis
qu’une réaction exothermique dégage de l’énergie
qui est absorbée par le milieu
b. Photosynthèse
c. Respiration cellulaire
18. a. Endothermique
b. Exothermique
c. Exothermique
19. a. 519 kJ
b. Absorbée

Christian Tremblay
20. a. Réaction chimique dans lequel un agent oxydant (O2,
Cl2, Br2) arrache les électrons de la substance avec
laquelle il est en contact. Cela crée donc un oxyde
b. Un feu, respiration cellulaire
c.
21. Comburant/Combustible/Point d’ignition
22. a. Combustion lente : Lorsqu’il n’y a pas de flamme,
mais bien un petit dégagement de chaleur qui est
rapidement dissipé dans le milieu
b. Combustion vive : Lorsqu’il y a une flamme et que
l’énergie dégagée est sous forme de chaleur et de
lumière. Il y a beaucoup d’énergie de dégagée.
c. Combustion spontanée : Le point d’ignition est plus
bas que la température ambiante.
23. a. Transformation chimique par laquelle les végétaux
transforment l’eau et le gaz carbonique en glucose et
en dioxygène
b. C’est grâce à la photosynthèse que les végétaux
produisent du glucose et le glucose est à la base de
chaque chaine alimentaire.
c. Les feuilles, mais plus particulièrement la
chlorophylle
24. L’inverse de la photosynthèse, donc elle produit du gaz
carbonique et de l’eau après avoir consumé du glucose et du
dioxygène
25. Parce que les réactifs d’une deviennent les produits de
l’autre et inversement.
1
/
4
100%