SK GUNDAM -
Cheikh Belhadj Bakir
Lakhadri Abedelhakim
Bou Amer Leila
République Algérienne Démocratique et Populaire
Centre universitaire de Ghardaïa
Institut de science de la nature et de la vie
Département 1année science et technologie
Groupe
de la chimie
Présentations : professeur :
Année universitaire :

SK GUNDAM -
Sommaire
Parte théorème
Les définitions
- base
- acido-basique conjugué
-
- équilibre acido-basique
- pH
-pH mètre
-papier de pH
-indicateurs colorés
-solutions tampons
But de TP
Parte expérimentale
- Matérielles
- Manipulation
Conclusion

SK GUNDAM -
Parte théorème
Les définitions
:
Un acide est un composé chimique pouvant libérer des protons (ions H+) en solution
aqueuse et on a deux types :
Acide forte : Un acide fort est un acide qui, en solution aqueuse, se dissocie facilement
et totalement en un proton H+ et une base très faible dite base conjuguée de l'acide
Acide fable : Un acide faible au contraire est beaucoup moins dissocié.
Remarque : La force d'un acide ou d'une base est donc caractérisée par son pKa
la base :
Une base un composé chimique pouvant libérer des ions hydroxydes (HO-) en
solution aqueuse.
Base forte : Une base forte est une base qui se dissocie totalement au cours de sa
réaction avec : NaO.
Base fable : base qui est contrer de base forte (ne se dissocie pas
totalement dans l'eau), EX :
acido-basique conjugué :
la base conjuguée : est un acide comme étant la molécule qui reste après avoir
perdu un proton.
L'acide conjuguée : est une base est la molécule qui a attrapé le proton (le proton
s'est ajouté à cette molécule de base).

SK GUNDAM -
:
Une espèce chimique qui appartient à deux couples acide / base en étant tantôt l'acide
tantôt la base est un ampholyte (on dit aussi amphotère).
L'eau est un ampholyte : HO+ / HO et HO / HO-
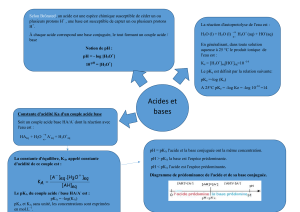
équilibre acido-basique :
:
AH + HO
A- + HO+ avec Ka=
HA,
la réaction :
B + HO
BH+ + OH-avec Kb=
: HO + HO
+ HO+ avec une constant
ke= . =.
Dans le milieu aqueux, les constantes :
Ke. Kb=Ke=.
pH :
Le potentiel hydrogène, plus connu sous le nom de "pH" permet de mesurer l'acidité ou la
basicité d'une solution qui est défini comme étant le log négatif de bas 10 de la concentration
de en unités est mol/l. qui définit avec formule suivent :pH=-log.
pH mètre :
Un pH-mètre est un appareil souvent électronique permettant la mesure du pH d'une
solution (acide/base).

SK GUNDAM -
papier de pH :
la tonalité correspondant au pH du milieu. Les laboratoires de chimie mis à part, on
croisera le papier pH dans le cabinet des médecins généralistes
indicateurs colorés :
Les indicateurs colorés de pH sont des molécules qui ont la capacité de changer de
. La propriété qui lie couleur
apparente et pH est appelée halochromisme. Par extension, l'indicateur de pH est un
détecteur chimique de l'ion hydronium (ou oxonium) HO+.
solutions tampons :
conjuguées ou inverse, qui sont capables de maintenir le pH à peu près constant lors de
ou
On prépare une solution tampon en mélangeant un acide et sa base conjuguée de
manière à ce que pour couple HA/on a :
HA + HO HO+ + A- avec Ka=
Et que la concentration en ions HO+ne dépend que du rapport des concentrations de
HA et
Si ce rapport ne varie pas de façon significative, le pH reste pratiquement constant.
et de sa
 6
6
 7
7
1
/
7
100%