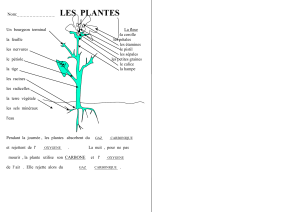
:L
Grenoble
Sciences
Grenoble Sciences poursuit
un
triple
objectif
:
realiser
des
ouvrages
correspondant
a un
projet
clairement
defini,
sans contrainte
de
mode
ou de
programme,
garantir
les
qualites
scientifique
et
pedagogique
des
ouvrages retenus,
proposer
des
ouvrages
a un
prix accessible
au
public
le
plus large possible.
Chaque
projet
est
selectionne
au
niveau
de
Grenoble Sciences avec
le
concours
de
referees
anonymes. Puis
les
auteurs travaillent pendant
une
annee
(en
moyenne)
avec
les
membres d'un comite
de
lecture interactif, dont
les
noms
apparaissent
au
debut
de
1'ouvrage.
Celui-ci
est
ensuite
public
chez
1'editeur
le
plus
adapte.
(Contact:
Tel.:
(33)4
76 51 46 95 -
E-mail:
Deux
collections existent chez
EDP
Sciences
:
la
Collection
Grenoble
Sciences, connue pour
son
originalite
de
projets
et sa
qualite
Grenoble
Sciences
-
Rencontres
Scientifiques,
collection
presentant
des
themes
de
recherche
d'actualite,
traites
par des
scientifiques
de
premier plan issus
de
disciplines
differentes.
Directeur
scientifique
de
Grenoble
Sciences
Jean
BORNAREL,
Professeur
a
1'Universite Joseph
Fourier,
Grenoble
1
Comite
de
lecture
pour
"Chimie.
Le
minimum
a
savoir"
4
R.
BARLET,
Professeur
a
1'Universite Joseph Fourier
-
Grenoble
1
B.
HATIER,
Maitre
de
conferences
a
1'Universite Nancy
1
4
D.
LALANDAIS,
Maitre
de
conferences
a
1'Universite Pierre
et
Marie Curie
-
Paris
6
Grenoble Sciences
rec,oit
le
soutien
du
Ministere
de la
Jeunesse,
de
1'Education
nationale
et de la
Recherche,
de la
Region
Rhone-Alpes,
du
Conseil general
de
Hsere
et
de la
Ville
de
Grenoble.
Illustration
de
couverture
:
Alice
GlRAUD
ISBN
2-86883-636-4
©
EDP
Sciences, 2003

CHIMIE
LE
MINIMUM
A
SAVOIR
Jacques
LE
COARER
17,
avenue
du
Hoggar
Pare
d'Activite
de
Courtaboeuf,
BP 112
91944
Les
Ulis
Cedex
A,
France

Ouvrages
Grenoble
Sciences
edites
par EDP
Sciences
Collection
Grenoble
Sciences
Electrochimie
des
solides
(C.
Deportes
et
al.)
-
Thermodynamique
chimique
(M.
Oturan
& M.
Robert)
-
Chimie
organometallique
(D.
Astruc)
-
Thermodyna-
mique chimique [CD]
(/.P.
Damon
& M.
Vincens)
Introduction
a la
mecanique
statistique
(E.
Belorizky
&
W.
Gorecki)
-
Mecanique
statistique.
Exercices
et
problemes corriges
(E.
Belorizky
& W.
Gorecki)
- La
symetrie
en
mathematiques,
physique
et
chimie
(/.
Sivardiere)
- La
cavitation.
Mecanismes
physiques
et
aspects industriels
(/.P.
Franc
et
al.)
- La
turbulence
(M.
Lesieur)
-
Magnetisme
: I
Fondements,
II
Materiaux
et
applications
(sows
la
direction
d'E.
du
Tremolet
de
Lacheisserie)
- Du
Soleil
a la
Terre.
Aeronomie
et
meteorologie
de
1'espace
(J.
Lilensten
&
P.L.
Blelly)
-
Sous
les
feux
du
Soleil. Vers
une
meteorologie
de
1'espace
(J.
Lilensten
& }.
Bornarel)
-
Mecanique.
De la
formulation lagrangienne
au
chaos
hamiltonien
(C.
Gignoux
& B.
Sihestre-Brac)
- La
mecanique quantique. Problemes
resolus,
Tomes
1 et 2
(V.M.
Galitsky,
B.M.
Karnakov
&
V.I.
Kogan)
-
Analyse
statistique
des
donnees
experimentales
(K.
Protassov)
Exercices
corriges d'analyse, Tomes
1 et 2 (D.
Alibert)
-
Introduction
aux
varietes
differentielles
(/.
Lafontaine)
-
Analyse
numerique
et
equations
differentielles
(J.P.
Demailly)
-
Mathematiques
pour
les
sciences
de la
vie,
de la
nature
et de la
sante
(F. &
J.P.
Bertrandias)
-
Approximation hilbertienne.
Splines,
ondelettes,
fractales
(M.
Atteia
&
J.
Caches)
-
Mathematiques pour
1'etudiant
scientifique,
Tomes
1 et 2
(Ph.].
Haug)
Bacteries
et
environnement. Adaptations physiologiques
(/.
Pelmont)
-
Enzymes.
Catalyseurs
du
monde vivant
(/.
Pelmont)
- La
plongee
sous-marine
a
1'air.
L'adaptation
de
1'organisme
et ses
limites
(Ph.
Foster)
-
L'ergomotricite.
Le
corps,
le
travail
et la
sante
(M.
Gendrier)
-
Endocrinologie
et
communications cellulaires
(S.
Idelman
& J.
Verdetti)
-
Elements
de
biologic
a
1'usage
d'autres
disciplines.
De la
structure
aux
fonctions
(sous
la
direction
de P.
Tracqui
& J.
Demongeot)
L'Asie,
source
de
sciences
et de
techniques
(M.
Soutif)
- La
biologie,
des
origines
a
nos
jours
(P.
Vignais)
-
Naissance
de la
physique.
De la
Sicile
a la
Chine
(M.
Soutif)
Minimum Competence
in
Scientific English
(/.
Upjohn,
S.
Blattes
& V.
Jans)
-
Listening
Comprehension
for
Scientific
English
(/.
Upjohn)
-
Speaking Skills
in
Scientific
English
(/.
Upjohn,
M.H.
Fries
& D.
Amadis)
Grenoble
Sciences
-
Rencontres
Scientifiques
Radiopharmaceutiques. Chimie
des
radiotraceurs
et
applications biologiques
(sows
la
direction
de M.
Comet
& M.
Vidal)
-
Turbulence
et
determinisme
(sows
la
direction
de
M.
Lesieur)
-
Methodes
et
techniques
de la
chimie
organique
(sous
la
direction
de
D.
Astruc)

POUR
LE
LECTEUR
Cet
ouvrage
n'est
pas
un
ouvrage
classique
et
peut etre utilise
de
diverses
fac.ons.
Decrivons
ici
quelques
exemples
d'utilisation
:
4
du
plan,
*
de la
liste
d'objectifs,
* des
elements
de
cours,
*
des
items*
et de
leurs
corriges,
4
des
problemes
et de
leurs corriges,
4
de
1'index
analytique
Cas
: je
prends
cet
ouvrage pour reconstituer
une
base solide
en
chimie
Schema
de
travail:
Dans
ce
cas,
le
lecteur
a une
vision globale
des
themes abordes
en
lisant
le
plan,
des
capacites
qu'il
va
acquerir
en
lisant
les
objectifs.
II
lira
le
premier
chapitre
puis,
avec
les
exercices progressifs (items)
developpera
certaines competences. Mais
cet
apprentissage
seul,
s'il
donne
une
bonne pratique
des
outils
et une
certaine
acquisition
des
connaissances peut conduire
a un
acquis
parcellise.
Des
problemes
plus
synthetiques
sont
proposes
:
ils
ne
doivent etre abordes
que
lorsque
les
numeros
d'items
etudies
sont d'un niveau plus
eleve
que
ceux
indiques
en
tete
des
problemes.
Si,
au
cours
de
1'apprentissage,
un
point bloque
par
oubli,
utiliser
1'index
analytique
ou,
plus
facile
encore, revenir dans
le
cours
a la
partie
concernee
:
elle
est
tres
souvent
indiquee
par son
code.
*
un
«
item
»
est un
exercice
court
ne
concernant
1'apprentissage
que
d'un
seul
objectif.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
1
/
184
100%