Lire l'article complet

C
ette table ronde concernant la désinfection en ORL
a réuni des ORL (F. Denoyelle, P. Lerault, A. Vuong),
un hygiéniste (J.C. Cêtre) ainsi que Mme la prési-
dente Annie Morat, de la 10ecour d’appel de Paris, qui a commenté
certains sujets.
OÙ EN EST-ON DES RISQUES DE TRANSMISSION
DE MALADIES À PRION ?
(F. Denoyelle)
Il existe deux formes de maladie à prion :
– la forme classique de la maladie de Creutzfeldt-Jakob (MCJ),
connue depuis longtemps, le plus souvent sporadique, dans
laquelle le prion se situe uniquement dans le système nerveux
central. Les malades à risque sont peu nombreux : cas familiaux,
traitement par hormone de croissance extractive (avant 1988),
greffe de dure-mère, interventions neurochirurgicales avant 1995,
signes cliniques neurologiques compatibles avec la MCJ ;
– la forme due au nouveau variant de la maladie de Creutzfeldt-
Jakob (vMCJ), décrite en 1996, et qui concerne les sujets jeunes.
La protéine prion anormale (PrPSc) est identique à celle de l’encé-
phalopathie spongiforme bovine. Chez les patients atteints, la
PrPSc a été retrouvée dans les tissus lymphoïdes de façon constante
à l’autopsie, mais également à un stade préclinique (Hill, Lancet
1999 ; 353 : 183-9). Toutes les populations exposées au risque
alimentaire doivent être considérées comme des malades à risque.
Cela concerne donc principalement la population du Royaume-
Uni (1 million de bovins infectés dans la chaîne alimentaire),
mais aussi, à un moindre degré, la France.
Au Royaume-Uni, 136 cas ont été prouvés depuis 1996 (âge > 11 ans),
le pic de la maladie se situant en 1999. Deux cent millions de livres
ont été débloqués en 2001, dont 25 millions pour le matériel à usage
unique d’amygdalectomie chez l’enfant. La PrPSc n’a cependant
jamais été retrouvée dans les pièces d’amygdalectomie, mais les
études n’ont porté que sur un petit nombre de patients (190 pièces,
Hilton et Ironside, Br Med J 2002). En France, l’exposition de
la population est estimée à 5 % de l’exposition au Royaume-Uni.
Six cas ont été prouvés ou probables, tous décédés, mais aucun cas
ou décès nouveau n’a été rapporté depuis 2002.
L’infection semble donc être derrière nous. Le faible nombre de
patients atteints pose le problème du coût des mesures prises
(6 décès en 7 ans). Ce risque infectieux a néanmoins permis
d’homogénéiser et de réglementer les pratiques de désinfection
du matériel (notamment fibroscope, matériel de consultation).
LA CIRCULAIRE MINISTÉRIELLE DGS 138 : “CM PRIONS” -
MODE D’EMPLOI ET ANALYSE
(J.C. Cêtre)
La circulaire DGS/5C/DHOS/E2 n° 138 du 14 mars 2001 rela-
tive aux précautions à observer lors des soins en vue de réduire
les risques de transmission d’agents transmissibles non conven-
tionnels (ATNC) préconise “la mise en œuvre de routine du plus
haut niveau de précautions compatible avec le dispositif médical
concerné”. Or, la spécificité du prion est sa résistance aux pro-
cédés physiques et chimiques d’inactivation, l’émergence du
nouveau variant de la MCJ, qui a conduit à l’exposition de la
population à l’agent de l’encéphalopathie spongiforme bovine
par voie alimentaire, et l’infectiosité élargie par le nouveau
variant (les amygdales, l’appendice et les tissus lymphoïdes sont
contaminés).
ACTUALITÉ
110eCongrès de la Société française d’ORL
et de chirurgie de la face et du cou (2). Désinfection en ORL
The 110th Congress of the French Society of ENT
and Head and Neck Surgery (2). Desinfection in ENT practice
●
I. Mosnier*
9
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no289-290 - janvier-février 2004
* Hôpital Louis-Mourier, AP-HP, 178, rue des Renouillers, 92700 Colombes.
Mots-clés : Transmission de maladies à prion - Circulaire ministérielle - Stérilisateurs - Usage unique - Stérilisation des nasofibroscopes.
Keywords: Prion transmission - Ministerial circular about prions - Autoclaves - Single use - Nasofibroscope sterilization.

●Les procédures d’inactivation du prion dépendent du niveau
de risque des patients, des tissus et de l’acte. Les niveaux de risque
des patients et des tissus sont rapportés dans les tableaux I et II.
L’acte est à risque élevé lorsqu’il existe un contact avec des tis-
sus considérés comme étant à risque infectieux (effraction, ulcé-
ration, contact prolongé supérieur à une heure).
●Les méthodes d’inactivation des agents transmissibles sont
classées en cinq groupes (tableau III).
●La sélection des dispositifs médicaux (DM) doit privilégier :
– des dispositifs à usage unique chaque fois qu’un tel matériel
existe, ou une protection à usage unique ;
– à défaut, du matériel recyclable autoclavable ;
– à défaut, du matériel supportant un traitement du groupe III
(soude, javel) ;
– à défaut, du matériel supportant un traitement du groupe II
(acide peracétique).
La traçabilité est nécessaire pour tout DM recyclable.
●Le traitement des DM recyclables comprend plusieurs étapes :
– le nettoyage est l’étape fondamentale : tremper immédiatement
le matériel dans un produit décontaminant pour éviter le séchage
des souillures, avec nécessité de deux nettoyages successifs si la
procédure d’inactivation n’est que partiellement efficace ;
– le séchage ;
– la procédure d’inactivation des ATNC selon le type de DM
(voir groupes, tableau III) : stérilisation à l’autoclave à 134 °C
pendant 18 minutes ou désinfection en remplaçant les produits
actuels par les produits les plus performants disponibles sur le
marché (proscrire les aldéhydes, inefficaces et susceptibles de
fixer fortement l’infectiosité résiduelle).
Le rinçage des produits doit être soigneux, “à l’eau de qualité
adaptée”. Les bains ne doivent pas être recyclés.
●Le choix de la procédure est rapporté dans le tableau IV. En
pratique, tous les patients sont actuellement potentiellement à
risque ; il est donc recommandé un autoclavage des DM (134 °C,
18 mn) ou une inactivation par acide peracétique (fibroscopes).
➥Deux ans après la parution de la circulaire, les craintes ini-
tiales d’épidémie de MCJ n’ont pas été confirmées par l’épidé-
miologie. L’évaluation du niveau de risque des patients, de l’acte
et des tissus est difficile. Ainsi, lorsqu’un saignement survient au
cours de l’utilisation d’un nasofibroscope, l’acte, même court,
devient à risque élevé ; le temps de contact avec le tissu conta-
minant conditionne le niveau de risque de l’acte, mais est discuté
(1 ou 2 heures ? 5 minutes pour certains...). L’acide peracétique
est également controversé quant à son activité sur les ATNC aux
concentrations utilisées et à sa stabilité, son efficacité sur les autres
agents contaminants (hépatite, VIH, etc.), sa tolérance par les maté-
riaux, sa toxicité pour le personnel (qui nécessiterait des flux
ACTUALITÉ
10
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no289-290 - janvier-février 2004
Tableau I. Niveau de risque des patients.
Patients sans caractéristiques particulières Tout patient est considéré comme étant à risque de transmission du nouveau variant
Patients présentant des facteurs de risque individuels ●Antécédent de traitement par hormone de croissance extractive (< 1988)
de la MCJ* classique ●Antécédent familial (famille génétique) d’un cas de MCJ*
●Antécédent d’intervention chirurgicale avec ouverture de la dure-mère (< 1995)
●Antécédent neurochirurgicaux sans traçabilité (étranger)
Patients suspects ou atteints ●Suspects : apparition récente, progressive, sans rémission, d’au moins un signe clinique évocateur
associé à des troubles intellectuels ou psychiatriques (après élimination de toute autre cause) :
ralentissement psychomoteur ou démence, ataxie cérébelleuse, troubles du comportement
●Atteints : résultats positifs d’un examen anatomopathologique
* MCJ : maladie de Creutzfeldt-Jakob.
Tableau II. Niveau de risque des tissus.
Tissus à risque infectieux élevé ●Système nerveux central (y compris hypophyse, dure-mère, LCR)
●Œil et nerf optique
●Formations lymphoïdes avec centres germinatifs : rate, ganglions lymphatiques, amygdales, formations
lymphoïdes de la sphère ORL, appendice
Tissus à risque infectieux faible Rein, foie, poumon, placenta
Incertitudes et imprécisions ●Sang : le risque semble très faible
●Actes dentaires majeurs : gencive, pulpe
Tableau III. Méthodes d’inactivation des “agents transmissibles non
conventionnels” (ATNC).
Groupe I Produits inefficaces : glutaraldéhyde, formol, éthanol,
chaleur sèche…
Groupe II Efficacité partielle : acide peracétique, soude,
dioxyde de chlore, autoclavage à 121 °C pendant 30 minutes
Groupe III Hypochlorite de sodium pendant 1 heure (2 % Cl-),
soude pendant 1 heure, autoclavage 134 °C
pendant 18 minutes en autoclave à charge poreuse
Groupe IV Efficacité maximale : procédures combinées
Groupe V Incinération > 800 °C

laminaires du fait de son caractère volatile) et son coût (3 à 6 fois
supérieur à celui des glutaraldéhydes). La sécurité principale
serait apportée par le double nettoyage.
Les décisions prises dans l’urgence ont donc abouti à une situa-
tion complexe. “Dans l’urgence du désir, il n’y a pas de bon dis-
cernement”.
STÉRILISATEURS À VAPEUR D’EAU SOUS VIDE
(P. Lerault)
La circulaire ministérielle DGS/5C/DHOS/E2 n° 138 du 14 mars
2001 rappelle que l’autoclavage devient obligatoire : “l’autocla-
vage est le seul procédé de stérilisation validé capable d’inactiver
l’infectiosité liée aux ATNC... Le matériel autoclavable ne doit
en aucun cas être traité par un autre mode de stérilisation que
l’autoclavage par vapeur d’eau saturée sous vide”. La future
norme européenne EN 13060 a pour but de permettre à tout pra-
ticien libéral isolé de choisir un petit stérilisateur à vapeur d’eau
(< 60 litres) sous vide, permettant de stériliser tout matériel sans
formation spécifique.
Ces stérilisateurs doivent répondre à certains critères :
●Trois cycles de stérilisation en fonction du type d’objet poreux
(avec cavités profondes et étroites : aspirateur) et/ou creux (cavités
peu profondes ou larges : curettes), emballés ou non emballés.
●Nécessité d’un système de vide (dit prévide fractionné) per-
mettant d’évacuer l’eau de stérilisation et de sécher parfaitement
le matériel. La valeur minimale du vide n’est pas fixée.
●Nécessité de sécurités verrouillant le système ou arrêtant le
cycle en cas de manque d’eau, de coupure d’électricité ou de sup-
pression de la vapeur. Le filtre à air de retour doit arrêter 99,5 % des
particules de plus de 0,3 µm. Le joint de porte doit être accessible,
démontable et facile à nettoyer. L’appareil doit avoir un purgeur
de cuve et deux électrovannes anti-retour air et eau.
●Nécessité d’un système de contrôle de la pression, de la tem-
pérature et du temps par des capteurs de pression et de tempéra-
ture indépendants (la pression et la température ne doivent pas
être déduits l’un de l’autre par calcul).
●Le tableau de commandes doit afficher la pression, la tempé-
rature et le type de cycle, indiquer le défaut ou l’arrêt de fonction-
nement du stérilisateur. Trois cycles sont recommandés
(134 °C/18 mn – 121 °C/30 mn – 125 °C/20 mn).
●L’inox est le matériau de construction à privilégier. Il faut
éviter le panachage (cuivre, nickel, chrome) en raison du risque
d’électrolyse aux jonctions et de dépôts galvaniques sur le matériel.
●Le contrôle quotidien du stérilisateur est indispensable par
trois tests (coût 15 €/jour) :
– test de Bowie et Dick : papier test vérifiant la capacité de l’auto-
clave à stériliser des objets poreux ;
– test de Helix : tube de téflon de 1,50 m vérifiant la capacité à
stériliser des objets creux ;
– test d’étanchéité : test de vide.
●L’imprimante (non thermique, car l’impression s’efface) sera
recommandée, voire obligatoire pour la traçabilité.
●Le matériel doit être nettoyé avant la stérilisation le plus parfai-
tement possible et à un moment le plus proche possible de l’acte
de stérilisation, puis ensaché.
Dès la parution des normes européennes, les stérilisateurs Poupinel
ne devront plus être utilisés. Le maintien en fonctionnement des
autres stérilisateurs, s’ils ne répondent pas totalement aux normes
européennes, sera “fonction des amortissements et de la sécurité
de stérilisation”. Actuellement, trois stérilisateurs sur le marché
répondent aux normes européennes (3 812 à 15 245 €). L’impri-
mante coûte 1 525 €ou est parfois intégrée dans le système. La
machine d’ensachage coûte 2 687 €et le consommable 3 000 €/an.
Une heure de main d’œuvre par jour est nécessaire. Au total, le
coût annuel de la stérilisation est d’environ 30 000 €par cabinet.
La norme européenne ne s’accompagne, bien sûr, d’aucune aide
financière.
POURQUOI UN DÉBAT SUR L’USAGE UNIQUE ?
(F. Denoyelle)
La lettre d’accompagnement de la circulaire DGS/5C/DHOS/E2
n° 138 du 14 mars 2001 de Mme Guigou et M. Kouchner “pré-
conise l’usage unique pour tout matériel en contact avec les tissus
à risque, dès lors que la qualité et la sécurité des soins sont assurés…
Un plan pluriannuel d’accompagnement financier est mis en
œuvre…”. Dans la circulaire, page 12 : “l’usage unique est prio-
ritairement recommandé pour les DM ou les parties amovibles
des DM difficiles à nettoyer, ainsi que pour les actes à risque
comportant un contact avec les tissus considérés comme infec-
tieux (en particulier amygdalectomie et adénoïdectomie)”.
11
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no289-290 - janvier-février 2004
Tableau IV. Choix de la procédure d’inactivation des ATNC pour les dispositifs médicaux recyclables.
Niveau de risque patient Niveau de risque tissu Désinfection
Catégorie 1
Patient “standard” – groupe III
sans facteur de risque – à défaut (fibroscope), groupe II + double nettoyage
d’une forme classique de MCJ*
Catégorie 2
Patient avec facteur de risque Tissu lymphoïde idem catégorie 1
d’une forme classique de MCJ* SNC, œil – groupe IV
– matériel thermosensible : procédure inactivation renforcée avec soude 2M
– à défaut (fibroscope), destruction
Catégorie 3
Patient atteint ou suspect N’importe quel tissu et acte – séquestration après 2 nettoyages manuels successifs
de MCJ* – si diagnostic confirmé : destruction
– si diagnostic non confirmé : réutilisation selon catégorie 1
* MCJ : maladie de Creutzfeldt-Jakob.

Trois formules de matériel à usage unique pour les amygdalec-
tomies sont disponibles :
– kit complet comprenant instruments, aspiration et bipolaire
(société Pouret, instruments en acier) ;
– instruments à “panacher” (société Medtronic, instruments en acier ;
société B. Braun, division Aesculap, instruments en polymère), d’uti-
li
sation très facile, bien adaptés à cette chirurgie. Le coût est de
150 à 180 €en moyenne. Il n’existe pas de cotation spécifique ;
– kit avec sonde de radiofréquence basse fréquence et instru-
mentation minimale (Coblator®).
➥Cent quatre-vingt mille adéno-amygdalectomies sont effec-
tuées chaque année en France. Le coût de la prise en charge de
l’usage unique en France est donc très élevé (200 millions de
francs) au vu de l’épidémiologie actuelle de la variante de la MCJ
(6 décès en 7 ans, pas de nouveau cas depuis 2002). De plus, le
risque infectieux n’est actuellement pas justifié, aucun cas de
transmission de MCJ par l’instrumentation ORL n’étant rapporté
à ce jour. L’autoclavage à 134 °C/18 mn semble donc suffisant
pour ce risque. Cependant, le coût du matériel à usage unique est
probablement intéressant si l’on prend en compte tous les coûts
de stérilisation et d’emballage d’une boîte (à rapporter au coût
d’achat et d’évacuation du matériel jetable). Le matériel peut éga-
lement être utile pour les patients présentant une maladie neuro-
logique douteuse ou pour les patients avec des facteurs de risque
de maladie classique du prion.
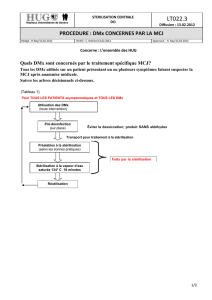
LA STÉRILISATION DES NASOFIBROSCOPES ORL
(P. Lerault)
●Un million et demi de nasofibroscopies sont réalisées chaque
année en France. Les procédures de désinfection dépendent du niveau
de risque de l’acte et du patient (tableau IV). Le niveau de risque
du patient doit être défini par un questionnaire pré-interventionnel
(tableau I). En l’absence de saignement, il s’agit d’un acte bref,
donc “non à risque”.
●En 2002, un projet de circulaire 236 révisée (non parue) stipule
que, “à défaut, pour le traitement des nasofibroscopes sans canal
opérateur utilisés dans un acte de durée brève et sans effraction,
en raison de la balance bénéfice/risque de l’examen et du fait de
la facilité de nettoyage de ce type de dispositifs médicaux, une
procédure simplifiée pourra être mise en œuvre. Cette procédure
simplifiée comprend : un simple nettoyage, une désinfection par
un produit du groupe II suivie d’un rinçage à l’eau du réseau. En
cas de saignement, qui peut laisser supposer un contact par effrac-
tion des tissus lymphoïdes potentiellement infectieux vis-à-vis
des ATNC, la procédure préconisée dans la présente circulaire sera
mise en œuvre”. La procédure citée comprend un prétraitement
(essuyage externe ou trempage), un premier nettoyage (10 minutes
minimum avec test d’étanchéité), une détersion par immersion
complète (solution détergente, lavage manuel), un rinçage inter-
médiaire abondant à l’eau du réseau, un deuxième nettoyage de
5 minutes minimum, un rinçage intermédiaire, une désinfection
par un produit du groupe II (acide peracétique conseillé) et un
rinçage terminal avant stockage.
●Les gaines de protection des fibroscopes (produit américain)
sont exclusivement distribuées en France par Bernas Medical.
L’étude d’étanchéité est en cours (AFSSAPS 2003/2004). Le coût
est de 12 €l’unité, 7 €en boîte de 100 (le coût de désinfection
manuelle du fibroscope dans une structure hospitalière moyenne
est estimé à 11,5 €). Cependant, l’agrément ministériel est en
attente, ce qui implique que, “en l’état, l’utilisation des gaines
protectrices pour les fibroscopes ne dispense pas de l’utilisation
des procédures de stérilisation et de désinfection en vigueur”
(ministère de la Santé, juin 2001).
COMMENTAIRES DE MME LA PRÉSIDENTE ANNIE MORAT
●Le rapport entre instrument contaminé et maladie est difficile
à prouver et est à établir par le ministère public et le patient. En
revanche, un arrêt en procédure civile (1999) a stipulé “l’obli-
gation de sécurité de résultats en ce qui concerne le matériel
d’exploration et de soin”. Le médecin peut donc être condamné
pour manque de moyens.
➥Il est nécessaire que la SFORL ou les sociétés savantes élaborent
des protocoles pratiques de mise en œuvre de ce qui est réalisable
et qu’elles fassent valider ces protocoles.
●Loi du 4 mars 2002 : les patients ont 10 ans pour porter plainte,
à compter de l’apparition du dommage (et non de l’acte). Il n’existe
pas de législation sur la durée de conservation des dossiers.
■
ACTUALITÉ
12
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no289-290 - janvier-février 2004
1
/
4
100%