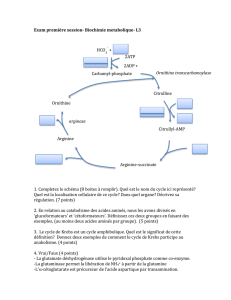
Oxydoréduction (pour étudiants) - Moodle UM

Faculté de Pharmacie
Séverine Denoyelle, MCF Chimie Thérapeutique
Réactions d’oxydation et de réduction
dans les processus biologiques
Université de Montpellier

1. Généralités
capable : - de capter des e-
- de se réduire capable : - de donner des e-
- de s’oxyder
Réaction d’oxydoréduction
2. Réactions catalysées par des enzymes
2.1. Généralités
Coenzyme
oxydée Coenzyme
réduite
NAD
+
NADP
+
FAD
FNM
NADH
NADPH
FADH
2
FNMH
2
Coenzyme
oxydée Coenzyme
réduite
NAD
+
NADP
+
FAD
FNM
NADH
NADPH
FADH
2
FNMH
2
FMN FMNH2
catalyse une réaction
de réduction
catalyse une réaction
d’oxydation

2.2. Les coenzymes dérivées du nicotinamide : le NAD+et le NADP+
réduction
oxydation
ON
OHOH
CH
2
O
P
O
P
O
O O
O O
NH
2
O
CH
2
ON
OHOH
N
N
N
NH
2
ON
OHOH
CH
2
O
P
O
P
O
O O
O O
NH
2
O
CH
2
ON
OHOH
N
N
N
NH
2
NAD
+
NADH
(OPO
32-
)
(NADP
+
)
(OPO
32-
)
(NADPH)
agent oxydant : agent réducteur :

Rappel :
NAD+:
(nicotinamide adénine dinucléotide)
Base
HO OH
O
O
P
O
P
O
P
O
H
O
O
O
O
OO
2'
3'
5' pentose
= ribose
= déoxyribose
liaison osidique
nucléoside
nucléotide monophosphate
nucléotide diphosphate
nucléotide triphosphate

2.2.1. NAD+/NADH
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%