Chapitre 27 - Précis d`anesthésie cardiaque

Précis d’Anesthésie Cardiaque 2011 – 27 Echocardiographie transoesophagienne 3ème partie 1
CHAPITRE 27
ECHOCARDIOGRAPHIE
TRANSOESOPHAGIENNE
3ème partie : pathologies
cliniques
Edition: Mai 2010
Mise à jour : Novembre 2011
Précis d’Anesthésie Cardiaque
PAC
PAC
•

Précis d’Anesthésie Cardiaque 2011 – 27 Echocardiographie transoesophagienne 3ème partie 2
Table des matières
Ischémie myocardique 2
Altérations cinétique segmentaire 2
IM ischémique 10
Complications de l’ischémie 13
Monitorage de l’ischémie 19
Chirurgie à cœur battant 21
OPCAB 21
Laser transmyocardique 24
Endoprothèses valvulaires 24
Plastie mitrale percutanée 30
Cardiomyopathies 34
Cardiomyopathie dilatative 34
Cardiomyopathie hypertrophique 35
Autres cardiomyopathies 41
Dysfonction ventriculaire 47
Insuffisance ventriculaire 47
Insuffisance ventriculaire : chirurgie 50
Pathologie péricardique 56
Péricardite 57
Tamponnade 59
Tamponnade postopératoire 65
Transplantation et urgences 68
Transplantation cardiaque 68
Transplantation pulmonaire 74
Traumatisme thoracique 75
Aorte thoracique 79
Examen de l’aorte thoracique 79
Athéromatose 84
Echographie épiaortique 86
Anévrysme 87
Dissection 90
Traumatisme aortique 97
Endoprothèses vasculaires 99
Interventions chirurgicales 100
Cardiopathies congénitales 103
Nomenclature anatomique 103
Retour veineux et oreillettes 113
Jonction auriculo-ventriculaire 122
Pathologies ventriculaires 125
Jonction ventriculo-artérielle 140
Segment artériel 149
ETO chez les congénitaux 152
Conclusions 154
Bibliographie 155
Auteurs 162
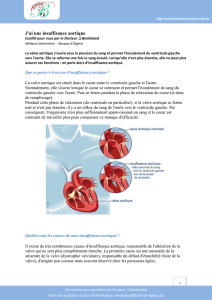
Ischémie myocardique
Altérations de la cinétique segmentaire (ACS)
Anatomie coronarienne
Dans une position intermédiaire entre la vue court-axe de la valve aortique (40°) et la vue court-axe de
l’aorte ascendante (0°), on aperçoit clairement l’origine du tronc commun (TC) au milieu du sinus de
Valsalva gauche (à 2 heures). Le départ de la coronaire droite (CD), au milieu du sinus de Valsalva
droit, est situé à 6-7 heures (Figure 27.1). Comme le trajet des deux vaisseaux n’est pas dans le même
plan, il est rare de les voir dans la même vue. La dimension des ostia coronariens est de 4-8 mm. Le
TC se divise en artère interventriculaire antérieure (IVA), qui se dirige verticalement vers le bas de
l’écran (flux parallèle à l’axe Doppler), et en artère circonflexe (CX), qui se dirige vers le sillon
auriculo-ventriculaire gauche et passe sous l’appendice auriculaire gauche (à droite de l’écran); on la
retrouve en court-axe en vue 2-cavités à 90°. La CD se coude peu après son départ pour s’orienter vers
la gauche de l’écran. La CD est également visible en long axe de la valve aortique (120°), où elle se
détache du sinus de Valsalva droit et se dirige vers le bas de l’écran. Selon l'orientation de l'aorte,
notamment dans les bicuspidies, il arrive que l'autre sinus de Valsalva en long-axe ne soit pas le non-
coronarien mais le coronarien gauche; on y voit alors le départ du TC (Figure 27.1C). Il existe une
multitude de variations anatomiques congénitales de l’arbre coronarien (voir Figure 27.147).
Au moyen du Doppler couleur, il est possible de visualiser le flux dans les 2-3 premiers centimètres
des troncs coronariens ; la limite de Nyquist est fixée à 0.5 m/s. Le flux est essentiellement diastolique
dans le TC, mais systolo-diastolique dans la CD. Le Doppler pulsé peut être correctement aligné avec

Précis d’Anesthésie Cardiaque 2011 – 27 Echocardiographie transoesophagienne 3ème partie 3
le flux dans l’IVA et dans la CD, ce qui en permet l’affichage spectral (Figure 27.2). Toutefois, cet
examen est peu précis parce que les vaisseaux suivent le mouvement translationnel et rotationnel du
cœur en systole ; ils se déplacent de haut en bas, ce qui modifie la Vmax enregistrée, et sortent souvent
de la fenêtre d’échantillonnage au cours du cycle cardiaque.
Figure 27.1 : Schéma anatomique des coronaires. A : Vue court-axe de l’aorte ascendante et de la valve aortique
0° - 40°, avec le tronc commun jusqu’à sa bifurcation (à 2 heures) et la coronaire droite (à 6 heures). B : Vue
long-axe 120° de la valve aortique et de l’aorte ascendante. C : Tronc commun court. Un TC court ou une
origine séparée de l’IVA et de la CX sont deux malformations précieuses à connaître avant d’administrer une
cardioplégie par canulation directe des coronaires. D : anévrysme de la coronaire droite. TC : tronc commun.
CX : artère circonflexe. IVA : artère interventriculaire antérieure. CD : artère coronaire droite. FCD : feuillet
coronarien droit de la valve aortique. FCG : feuillet coronarien gauche. FNC : feuillet non-coronaire. APD :
artère pulmonaire droite. ST : sinus transverse.
Figure 27.2 : Flux coronaire. A : flux dans l’artère interventriculaire antérieure (IVA) en vue basale court axe de
la valve aortique à 40° ; la composante systolique S est de faible vélocité. B : flux dans la coronaire droite en vue
long axe de la valve aortique à 120° ; le flux systolique S est plus important que le flux diastolique D.
CCVD
Anévr
VAo
OG
OD
FCD
FCG
IVA
TC
CD
CX
FNC
FCD
OG
Ao
APD
VD
CCVG
ST
*
CD
Septum
interauric
D
C
B
A
Systole
Diastole
S
D
Vélocité
Systole
Diastole
S
D
© Chassot 2010
A
B

Précis d’Anesthésie Cardiaque 2011 – 27 Echocardiographie transoesophagienne 3ème partie 4
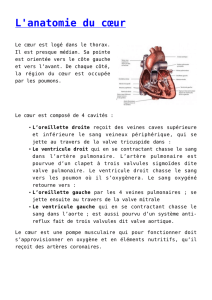
Contraction segmentaire
La perfusion myocardique est répartie en 3 territoires correspondant aux 3 troncs coronariens : artères
coronaire droite (CD), interventriculaire antérieure (IVA) et circonflexe (CX) (Figure 27.3). Le VG
est subdivisé en 4 parois selon son court-axe (parois antérieure, latérale, postérieure et septale) et en 3
régions selon son long axe (régions basale, médio-ventriculaire et apicale), qui sont mises en évidence
dans les différentes vues :
En vue 4-cavités rétrocardiaque à 0°, parois septale et latérale du VG ;
En vue 2-cavités rétrocardiaque à 90°, parois antérieure et inférieure du VG ;
En vue long-axe rétrocardiaque à 120°, paroi postérieure et antéro-septale ;
En vue transgastrique court-axe à 0°, parois septale, inférieure, postérieure, latérale et
antérieure du VG (en tournant dans le sens horaire) ; cette incidence visualise simultanément
les trois territoires coronariens dans leurs segments médio-ventriculaires, mais les deux tiers
du VG échappent à cette vue, qui ne met en évidence que 17% des altérations de la cinétique
segmentaire [140] ;
L'apex anatomique est visible en 2 cavités à 90° et en long-axe à 120° ; c’est la région la plus
difficile à visualiser correctement en ETO ; elle présente un degré d’épaississement supérieur
au reste du VG.
Selon la nomenclature actuelle, le corps du VG est divisé en 17 segments (Figure 27.4) [28]. Cette
numérotation commence au sillon interventriculaire antérieur à la base (segment 1) et tourne dans le
sens anti-horaire en regardant le VG depuis devant. La zone basale et la zone médio-ventriculaire
comprennent chacune 6 segments, et la zone apicale seulement quatre ; le 17ème segment est la coiffe
apicale au-delà de la cavité ventriculaire.
La contraction segmentaire est caractérisée par deux mouvements : un épaississement et un
raccourcissement. Les deux éléments doivent être présents pour que la contraction puisse être qualifiée
Figure 27.3 : Territoires
coronariens en vue court
axe transgastrique (TG), en
vues 2 cavités et 4 cavités
rétrocardiaques, et en vue
schématique. Cette dernière
est une projection cir-
culaire de la vascularisation
des différents segments.
CD : artère coronaire
droite. CX : artère
circonflexe. IVA : artère
interventriculaire
antérieure. Les segments
13, 15 et 17 peuvent être
vascularisés par la CD
(interventriculaire
postérieure) ou l’IVA
(interventriculaire
antérieure). Le segment 14
peut être vascularisé par
l’IVA ou la CX, et le
segment 16 par la CX ou la
CD.
© Chassot 2011
90°
CD
CX
IVA
Vue 2 cavités
Ant
Vue 4 cavités
Post
Apex
Vue court axe TG
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Vue schématique
Lat
CX
CD
IVA
0°

Précis d’Anesthésie Cardiaque 2011 – 27 Echocardiographie transoesophagienne 3ème partie 5
de normale. En systole, le myocarde s'épaissit de 30 à 45% ; le raccourcissement radiaire est de 20-
45% et le raccourcissement longitudinal de 15-20%; la torsion systolique du VG est de 15-20°. La
grande fourchette de ces valeurs vient du fait que la course radiaire de chacune des 4 parois du VG
n’est pas la même (Figure 27.5) [94].
Paroi latérale : 45% ;
Paroi antérieure : 38% ;
Paroi postérieure : 30% ;
Paroi septale : 20%.
La partie sous-endocardique a un déplacement radiaire qui est le double de celui de la partie sous-
épicardique. L’épaississement et le mouvement de torsion systolique sont plus importants à l’apex. La
contraction commence à l’apex et se termine dans la chambre de chasse. Cette hétérogénéité de la
contraction ventriculaire gauche a des conséquences sur l’examen échocardiographique.
Figure 27.4 : Numérotation
des 17 segments du VG. La
numérotation débute au sillon
interventriculaire antérieur à
la base du ventricule et tourne
dans le sens anti-horaire ; il y
a 6 segments au niveau du
tiers basal, 6 au niveau du
tiers médio-ventriculaire et 4
au tiers apical ; le 17ème
segment est la coiffe apicale
[20].
1
2
3
4
5
6
8
9
10
11
12
7
13
14
15
16
17
VD
© Chassot 2011
Apex
40
20
40
20
40
20
40
20
Lat
Ant
Sept
Post
Base
Raccourcissement radiaire (%)
Mi-VG
Figure 27.5 : Les quatre
quadrants du VG n’ont pas le
même raccourcissement
radiaire. Ce dernier est plus
important dans les parois
latérale et antérieure, et plus
faible dans les parois
postérieure et septale. Il est
plus marqué à la base qu’à
l’apex dans les parois
antérieure et latérale, mais
plus faible à la base dans la
paroi postérieure ; de ce fait,
la partie postéro-basale
semble souvent hypo-
kinétique par rapport au reste
du VG. Le septum a la course
radiaire la plus faible [94].
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
1
/
162
100%