Contrôle par changement de réactif

Ch15 C
ONTROLE PAR CHANGEMENT DE REACTIF
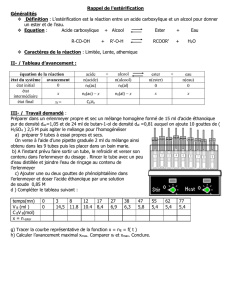
Les réactions d’estérification et d’hydrolyse étaient lentes et limitées. On sait déjà qu’on peut augmenter
la vitesse de réaction d’estérification en augmentant la température ou en ajoutant un catalyseur
et améliorer le rendement de la réaction d’estérification en mettant un réactif en excès ou en éliminant
un des produits formés au cours de sa formation.
Cependant ces méthodes coûtent en matière et énergie.
Il faut essayer avec d’autres réactifs de façon à rendre impossible la réaction inverse, par exemple en
effectuant l’estérification sans qu’il se forme d’eau ou en effectuant l’hydrolyse d’un ester de façon à ce
que l’alcool formé ne soit pas en présence d’un acide.
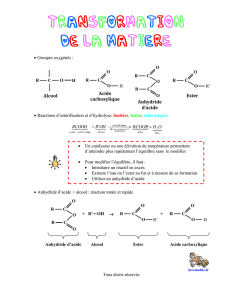
1. La synthèse d’esters à partir d’anhydrides d’acide.
1.1. le groupe caractéristique anhydride d’acide.
Le groupe caractéristique anhydride d’acide est décrit par la formule développée :
Les anhydrides d’acide proviennent de l’élimination d’une molécule d’eau (par action d’un déshydratant
ou parfois par simple chauffage) lors de la réaction entre deux acides carboxyliques :
La nomenclature de l’anhydride s’obtient en remplaçant le mot acide par anhydride devant le nom
de l’acide carboxylique. Dans le cadre ci-dessus, si le groupe R― est un groupe méthyle, on obtiendra
de l’anhydride éthanoïque (acétique).
Ce sont des liquides ou des solides à température et pression ordinaires.
Ils sont corrosifs et irritants pour la peau et les yeux.
Un anhydride d'acide est donc beaucoup plus réactif que l'acide carboxylique correspondant
et donne lieu en général, à une réaction totale, rapide et exothermique.
1.2. Changement de réactif lors d’une estérification.
La réaction entre un acide carboxylique et un alcool est une réaction lente et limitée (Ch14):
Remplacer l’acide carboxylique par l’anhydride d’acide correspondant, permet d’obtenir le même ester,
mais la réaction correspondante est rapide et totale :
O O
║ ║
―C―O―C―
O O
║ ║
R―C―OH + R’―OH = R―C―O―R’ + H
2
O
(ℓ)
acide alcool ester eau
O O O O
║ ║ ║ ║
R―C―O―C―R + R’―OH = R―C―O―R’ + R― C―OH
anhydride d’acide alcool ester acide
R C O
OH
R C O
OH
H
+
=
R C O
R C O
O
+
H
2
O

1.3. Application : l’hémisynthèse de l’aspirine.
L’aspirine (acide acétylsalicylique) peut être obtenue à partir d’acide salicylique. L’estérification à
l’aide d’acide éthanoïque conduit à un rendement très faible, on préfère utiliser, en grand excès, de
l’anhydride éthanoïque, afin d’obtenir un rendement maximal (voir TPch12) :
acide salicylique anhydride éthanoïque acide acétylsalicylique acide éthanoïque
Au terme de la synthèse puis filtration Büchner, on peut procéder à
une recristallisation qui est un procédé de purification d'un produit solide
(voir §C p288)
.
2. L’hydrolyse basique des esters : la saponification.
La saponification est le nom de la réaction entre un ester et les ions hydroxyde :
c’est une hydrolyse de l’ester en milieu basique.
C’est une réaction totale, rapide et exothermique.
Elle conduit à un alcool et à un ion carboxylate (base conjuguée de l’acide carboxylique).
3. Les savons.
3.1. Les corps gras.
Les corps gras sont des composés naturels, d’origine animale ou végétale, insolubles dans l’eau.
On les nomme souvent : les lipides.
Ce sont des triglycérides, c'est-à-dire des triesters, provenant de l’estérification entre le propane-1,2,3-
triol (glycérol) et des acides gras.
Ces derniers sont des acides carboxyliques à longue chaîne carbonée non ramifiée, comme l’acide
oléïque C
17
H
33
CO
2
H par exemple.
3.2. La saponification des corps gras.
Cette transformation est réalisée avec des solutions d’hydroxyde de sodium ou soude
ou d’hydroxyde de potassium ou potasse . Elle conduit à la formation de
glycérol et de carboxylates de sodium ou de potassium (bases conjuguées des acides gras),
qui constituent les savons :
Voir mode opératoire p291
O O
║ ║
R―C―O―R’ + HO
–
(aq)
=
R―C―O
–
(aq)
+ R’―OH
Ester ion hydroxyde ion carboxylate alcool
CH
3
CO
CH
3
CO
O
COH
O
OH
+
COH
O
OC
O
CH
3
+
CH
3
CO
OH

3.3. Propriétés des savons.
3.3.1. La solubilité des savons.
Les savons sont solubles dans l’eau distillée, mais beaucoup moins dans l’eau salée (voir l’opération de
relargage) et dans les eaux dures (contenant beaucoup d’ions calcium et magnésium) où ils précipitent.
3.3.2. Le mode d’action des savons.
L’ion carboxylate d’un savon est un composé amphiphile, qui possède une tête polaire hydrophile (et
donc lipophobe) et une longue chaîne carbonée apolaire hydrophobe (et donc lipophile) :
Du fait de ces propriétés antagonistes, les ions carboxylates forment, en solution aqueuse, des
assemblages particuliers : un film interfacial et des micelles :
Ce sont ces micelles qui permettent d’expliquer le caractère détergent des savons :
Animation :
http://chimie.scola.ac-paris.fr/flash/micelles.htm
4. Exercices.
n°8, 12 et 21 p 298…
Bac Afrique 2005 : http://www.labolycee.org/2005/2005-Afrique-Sujet-Exo3-Beurre-4pts.pdf
1
/
3
100%