Vers une reconnaissance du rôle des lymphocytes T CD4 dans le

Journal Identification = VIR Article Identification = 0459 Date: October 18, 2012 Time: 5:12 pm
éditorial
Virologie 2012, 16 (5) :271-5
Vers une reconnaissance du rôle des lymphocytes
T CD4 dans le contrôle des infections virales
Lisa A. Chakrabarti
Institut Pasteur,
unité de pathogénie virale,
28, rue du Docteur-Roux,
75724 Paris cedex 15, France
<chakra@pasteur.fr>
Les lymphocytes T CD8 sont considérés comme les acteurs majeurs de
la réponse antivirale, du fait de leur capacité à éliminer spécifiquement
les cellules infectées. Cependant, une série d’articles récents documente
un rôle non négligeable, et parfois dominant, des lymphocytes T CD4 dans le
contrôle de certaines infections virales chez l’homme [1-5]. Ces études sont
basées sur un suivi des étapes très précoces de l’infection, avec une analyse fine
de l’ensemble des épitopes viraux reconnus par les lymphocytes T CD4, et la mise
en œuvre de nouveaux outils tels que les tétramères de molécules du complexe
majeur d’histocompatibilté (CMH) de classe II [6]. La notion qui émerge de
ces travaux est qu’en plus de leur fonction helper, déjà bien caractérisée dans la
réponse anticorps, les lymphocytes T CD4 semblent pouvoir exercer une activité
antivirale directe soit par cytotoxicité pour les cellules cibles exprimant le CMH
de classe II, soit par sécrétion de médiateurs solubles inhibant directement ou
indirectement la réplication virale.
Prédominance des réponses T CD4
dans l’infection par le virus de l’hépatite A
Zhou et al. [1] ont réalisé un suivi particulièrement détaillé des étapes précoces
de l’infection par le virus de l’hépatite A (HAV) chez le chimpanzé, avec des pré-
lèvements bihebdomadaires dans le foie et le sang. La cartographie des épitopes
peptidiques du HAV reconnus par les lymphocytes T CD4 et CD8 de deux chim-
panzés montre un répertoire épitopique nettement plus étendu pour la population
T CD4, que ce soit dans le foie ou dans le sang périphérique. Le développement
de la réponse T CD4 à la semaine 4 postinoculation s’accompagne d’un déclin de
la virémie (figure 1). Les réponses T CD4 déclinent ensuite de fac¸on biphasique,
rapidement durant le deuxième mois de l’infection, puis plus lentement avec une
persistance sur plus de 30 semaines, avec une évolution parallèle à la présence
du HAV dans le foie. En revanche, les réponses T CD8 sont d’amplitude nette-
ment plus faible et sont détectables principalement entre les semaines 4 et 10. La
décroissance rapide des réponses T CD8, alors que la réplication virale persiste
dans le foie, suggère que ces cellules ne sont pas les principaux effecteurs de
la réponse antivirale dirigée contre le HAV. Les rares T CD8 qui restent détec-
tables aux étapes tardives de l’infection ont un phénotype de cellules mémoires
exprimant fortement le récepteur CD127 à l’interleukine 7 (IL-7) et peu le mar-
queur programmed cell death protein 1 (PD-1), et ne montrent donc pas les
signes classiques d’épuisement immunitaire associés à des virémies élevées dans
d’autres infections virales (VIH, lymphocytic choriomeningitis virus [LCMV]).
Les cellules T CD4 sont quant à elles polyfonctionnelles, avec production des
cytokines IL-2, tumor necrosis factor ␣(TNF-␣), interféron ␥(IFN-␥), et IL-
21 durant les 30 premières semaines de l’infection, puis persistance uniquement
des réponses IL-2 et TNF-␣une fois la virémie contrôlée dans le foie. Là encore,
la persistance des réponses IL-2 exclut a priori un épuisement immunitaire.
Zhou et al. proposent que la perte progressive des réponses T CD8 soit liée
Tirés à part : L.A. Chakrabarti
doi:10.1684/vir.2012.0459
Virologie, Vol 16, n◦5, septembre-octobre 2012 271
Pour citer cet article : Chakrabarti LA. Vers une reconnaissance du rôle des lymphocytes T CD4 dans le contrôle des infections virales. Virologie 2012; 16(5) : 271-5 doi:10.1684/vir.2012.0459
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = VIR Article Identification = 0459 Date: October 18, 2012 Time: 5:12 pm
éditorial
Réponse T CD4
Réponse T CD4 à potentiel
cytotoxique (CD107a+)
Virémie
Réponse T CD8
1
2
3
4
5
6
Sida Phase chronique
(années)
Phase chronique
(années)
Phase chronique
(années)
1
2
3
4
5
6
1
2
3
4
5
6
Cirrhose
1
2
3
4
5
6
VHA
Primo-infection
(semaines)
1
2
3
4
5
6
log
ARN VHA
log
ARN VHC
log
ARN VHC
log
ARN VHC
log
ARN VIH
log
ARN VIH
Réponse T (cytokine +)Réponse T (cytokine +)Réponse T (cytokine +)
Réponse T (cytokine +) Réponse T (cytokine +)
Résolution de
l’infection
Primo-infection
(semaines)
Primo-infection
(semaines)
Résolution de
l’infection
Primo-infection
(semaines)
Primo-infection
(semaines)
VHA : infection contrôlée
VHC : infection contrôlée
VIH : infection contrôléeVIH : infection progressive
VHC : infection progressive
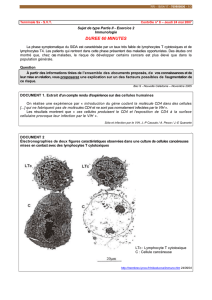
Figure 1. Représentation schématique de la cinétique des réponses T dans les infections à VHA, VHC, et VIH.
Infection à VHA : d’après Zhou et al. [1], les réponses T CD8 ne sont détectées que brièvement durant la primo-infection, alors que les
réponses T CD4 sont de plus grande amplitude et suivent l’évolution de la virémie dans le foie. Infection à VHC : d’après Schulze zur Wiesch
et al. [2], les réponses T CD4 ne sont détectées que brièvement dans les infections progressives, alors qu’elles persistent plus longtemps
dans les infections contrôlées. Infection à VIH : d’après Soghoian et al. [3], la présence de T CD4 à potentiel cytotoxique en primo-infection
(CD107a +) est associée à un meilleur contrôle de l’infection. Les patients parvenant à contrôler spontanément la réplication du VIH sur le
long terme (graphe de droite) sont particulièrement rares (moins de 0,5 % des patients séropositifs).
272 Virologie, Vol 16, n◦5, septembre-octobre 2012
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = VIR Article Identification = 0459 Date: October 18, 2012 Time: 5:12 pm
éditorial
à la faible réponse interféron associée à l’infection HAV,
comme l’indique l’induction limitée des gènes induits
par l’interféron (ISG) dans le foie [7]. Il est établi que
l’activation et l’amplification clonale des lymphocytes
T CD8 est fortement dépendante de l’induction des interfé-
rons de type I lors des étapes initiales des infections virales
[8, 9]. Le contexte immunitaire du foie est toutefois parti-
culier, de multiples mécanismes immunomodulateurs (dont
une forte expression de programmed cell death 1 ligand
1[PDL-1] et d’IL-10) étant mis en œuvre pour limiter la
destruction des hépatocytes par cytotoxicité et préserver
cet organe vital [10]. Il est possible que le HAV par-
vienne à exploiter ces mécanismes immunomodulateurs
hépatiques, résultant dans une réponse inflammatoire de
faible intensité et menant à l’atténuation des réponses T
CD8 et à la prédominance des réponses T CD4. Le fait que
le HAV soit finalement éliminé de l’organisme infecté, chez
le chimpanzé ou l’homme, suggère que les lymphocytes
T CD4 contribuent directement à la clairance du virus.
La persistance des réponses T CD4
précoces est associée au contrôle
du virus de l’hépatite C
Dans le cas de l’infection par le virus de l’hépatite
C (HCV), l’induction de la réponse inflammatoire en
primo-infection paraît plus marquée que dans le cas du
HAV, même si elle reste en dec¸à de celle observée dans
l’infection à VIH [11]. Le rôle protecteur des réponses
T CD8 spécifiques du HCV est bien établi, avec en par-
ticulier une corrélation entre la présence de lymphocytes
T CD8 ayant une forte avidité pour les épitopes HCV
et la résolution de l’infection [12]. Cependant, un article
récent vient de mettre en lumière le rôle très précoce de
la réponse T CD4 contre HCV [2]. Schulze zur Wiesch
et al. ont étudié en détail le développement de la
réponse cellulaire antivirale chez 31 patients en cours
d’infection aiguë par HCV, suite à une transmission
iatrogénique, une injection de médicament avec seringue
contaminée, ou une piqûre d’aiguille accidentelle en
milieu hospitalier. Des réponses T CD4 à large spectre
sont présentes chez la grande majorité des patients aux
temps très précoces, mais elles disparaissent rapidement
(en trois mois) chez les patients incapables de contrô-
ler l’infection et évoluant vers la chronicité, alors que
les réponses ne décroissent que très lentement chez les
patients qui résolvent l’infection (figure 1). Ces données
remettent en cause la notion selon laquelle la réponse
T CD4 n’apparaîtrait pas chez les patients qui deviennent
porteurs chroniques du VHC. La possibilité d’analyser les
réponses T durant les premières semaines de l’infection
et d’évaluer les épitopes reconnus dans l’ensemble du
protéome du VHC ont permis à Schulze zur Wiesch
et al. d’identifier des réponses T CD4 très précoces qui
avaient auparavant échappé à l’analyse. À l’aide de mar-
quages par tétramères du CMH de classe II, ces auteurs
ont pu caractériser la dysfonction progressive des cellules
T CD4 spécifiques du VHC, avec la perte rapide de leur
capacité proliférative et leur appauvrissement chez les
porteurs chroniques. De fac¸on intéressante, un traitement
précoce durant les trois premiers mois de l’infection semble
capable de restaurer la réponse T CD4, au moins partielle-
ment, alors qu’un traitement plus tardif n’a pas cet effet.
On peut établir un parallèle avec l’infection par le VIH,
dans laquelle les réponses prolifératives des T CD4 sont
rapidement perdues chez les patients évoluant vers une viré-
mie chronique, et pour laquelle une thérapie antirétrovirale
précoce permet la préservation de ces réponses [13].
La présence de cellules T CD4
à potentiel cytotoxique durant
la primo-infection est associée
à une évolution plus lente
de l’infection par le VIH
Selon certain auteurs, la perte rapide des réponses
T CD4 observée dans l’infection à VIH ne ferait que reflé-
ter un épuisement immunitaire lié à la persistance d’une
virémie élevée, mais ne contribuerait pas à l’augmentation
de la virémie [14]. En effet, la stimulation continue des cel-
lules T via leur T-cell receptor (TCR) mène au basculement
d’un phénotype mémoire vers un phénotype effecteur avec
perte de capacité de synthèse d’IL-2, d’où perte de capacité
proliférative, accumulation de molécules co-stimulatrices
inhibitrices, et susceptibilité à l’apoptose. Cependant,
d’après d’autres études, les lymphocytes T CD4 antiviraux
sont doués de capacité cytotoxique ou virostatique, et leur
perte contribue directement à l’augmentation de la répli-
cation virale [4, 15, 16]. Ainsi l’étude de Soghoian et al.
documente la présence précoce de T CD4 à potentiel cyto-
toxique lors de la primo-infection par le VIH, et montre
qu’un taux élevé de ces cellules est associé à une évolution
plus favorable de l’infection, avec stabilisation de la réplica-
tion virale à un niveau (setpoint) plus bas [3]. Entre deux et
six mois postdiagnostic, les patients à setpoint bas montrent
une augmentation des cellules T CD4 spécifiques de Gag
capables de synthétiser de l’IFN-␥et de dégranuler (expres-
sion du marqueur LAMP/CD107a), alors qu’au contraire la
fréquence de ces cellules diminue chez les patients à set-
point haut. De plus, la présence d’une forte proportion de
cellules T CD4 spécifiques exprimant la molécule lytique
Granzyme A au tout début de la primo-infection, au moment
du diagnostic, est associée à une évolution favorable et à
un setpoint bas (figure 1). Des tests in vitro ont confirmé
Virologie, Vol 16, n◦5, septembre-octobre 2012 273
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = VIR Article Identification = 0459 Date: October 18, 2012 Time: 5:12 pm
éditorial
la capacité des T CD4 prélevés lors de la primo-infection
à inhiber la réplication du VIH dans des macrophages
autologues infectés, ce qui suggère une action cytotoxique
directe. Notons toutefois que le pouvoir cytotoxique des
T CD4 semble modéré par rapport à celui des cellules T
CD8 et se focalise sur les cellules exprimant un fort niveau
de molécules du CMH de classe II, nécessaires à la présenta-
tion des peptides Gag reconnus par les T CD4. Il est frappant
que, dans la cohorte étudiée par Soghoian et al., l’amplitude
des réponse T CD8 mesurée aux temps précoces ne dis-
tingue pas les groupes de patients évoluant favorablement
ou non, alors que les réponses T CD4 sont elles prédictives
d’une évolution favorable. On peut noter que les patients
de cette cohorte n’étaient pas préférentiellement porteurs
d’allèles protecteurs du CMH de classe I, tels que HLA
B57 et B27, qui sont associés à des réponses T CD8 efficaces
en primo-infection, et qui sont préférentiellement exprimés
par les patients dits HIV controllers capables de contrô-
ler spontanément la réplication du VIH sous le seuil des
50 copies d’ARN viral/mL [17]. On pourrait donc distinguer
deux classes de patients montrant une évolution favorable
de l’infection à VIH avec un groupe de patient exprimant
les allèles B57 et B27, pour qui une réponse T CD8 précoce
serait prédominante, et un second groupe de patients où
les réponses T CD4 pourraient jouer un rôle protecteur.
D’après une étude récente en modèle simien, une déplétion
partielle des lymphocytes T CD4 avant l’inoculation du
SIVmac accélère la progression de l’infection, ce qui
renforce la notion d’un rôle nécessaire de la population
T CD4 dans l’établissement des réponses antivirales [18].
Conclusion : les lymphocytes T CD4 +
contribuent au contrôle viral
par de multiples mécanismes
Il serait réducteur de limiter le rôle antiviral direct des lym-
phocytes T CD4 à leur capacité cytotoxique. Ces cellules
sécrètent également des médiateurs solubles, dont des cyto-
kines et chimiokines capables d’inhiber la réplication du
VIH. Ainsi, l’IFN-␥peut contribuer à l’induction d’ISG
agissant directement en tant que facteurs de restriction du
VIH, tels SAMHD1, APOBEC3G/F, ou la Tetherin [19, 20].
La sécrétion des -chimiokines RANTES, MIP-1␣,et
MIP-1peut mener à l’occupation et à l’internalisation
du corécepteur CCR5, inhibant ainsi l’entrée du VIH
dans ses cellules cibles [21]. De plus, les lymphocytes
T CD4 orchestrent l’aide fournie à de multiples effecteurs
du système immunitaire, en favorisant diverses fonctions
effectrices suivant leur état de différentiation : les cellules
T helper 1 (Th1) activent macrophages et cellules dendri-
tiques, et fournissent une aide spécifique aux lymphocytes
T CD8 ; les Th2 et les T follicular helper (Tfh) aident à la
maturation des lymphocytes B et à la production d’anticorps
de forte affinité ; les Th17 et les Th22 contribuent à
l’intégrité des muqueuses intestinales et au développement
de l’immunité antibactérienne et antifongique [22]. Une
fonction helper souvent sous-estimée est celle d’aide au
recrutement des cellules effectrices de l’immunité innée :
les cellules T CD4 mémoire, de par leur capacité à sécré-
ter rapidement des quantités importantes d’IFN-␥et de
TNF-␣lorsqu’elles reconnaissent leur antigène, induisent
la sécrétion de cytokines (IL-1, IL-6, IL-12) et de chimio-
kines inflammatoires (CCL2, CXCL9, CXCL10) par les
cellules présentatrices environnantes. Celles-ci recrutent à
leur tour des médiateurs de l’immunité innée comme les
cellules NK, NKT, ou les neutrophiles sur le site tissulaire
infecté [23]. À cette fonction s’ajoute le recrutement des
cellules T CD8 effectrices exprimant CXCR3, le récepteur
activé par les chimiokines CXCL9 et CXCL10 [24]. Lors
d’une infection virale aiguë activant fortement la réponse
inflammatoire via les récepteurs de motifs propres aux
pathogènes (pattern recognition receptors [PRR]), les cel-
lules T CD4 ne sont pas indispensables à l’établissement
d’une réponse T CD8 efficace car les cellules présentatrices
sont déjà activées [9]. En revanche, dans le cadre d’une
infection virale chronique, l’aide fournie par les cellules
Th1 est essentielle au maintien de réponses T CD8 effi-
caces sur le long terme. Les modèles murins d’infection
chronique suggèrent qu’en absence de T CD4 helper, les
lymphocytes T CD8 adoptent un phénotype d’épuisement,
perdent leur capacité proliférative, et sont sujets au suicide
« fratricide » par la voie de tumor-necrosis-factor related
apoptosis inducing ligand (TRAIL) [25, 26].
Le cas de l’infection à VIH est particulier, car l’induction
de fonctions T CD4 helper est contrebalancée par le fait
que les T CD4 activées représentent les cibles les plus per-
missives à la réplication du VIH. Le problème est d’autant
plus aigu que les cellules T CD4 spécifiques des antigènes
du VIH semblent préférentiellement infectées et déplé-
tées [27]. Toute stratégie vaccinale devra donc veiller à ne
pas induire un surplus de cibles T CD4, phénomène qui
pourrait expliquer l’effet facilitant observé dans certains
essais cliniques [28, 29]. D’un autre côté, l’essai vaccinal
RV144 mené en Thaïlande montre un modeste effet protec-
teur associé à l’induction de réponses T CD4 anti-VIH [30],
suggérant qu’il est possible de trouver un équilibre où les
fonctions antivirales des T CD4 prédominent sur leur effet
facilitant. Une piste serait de parvenir à induire préféren-
tiellement des cellules T CD4 effectrices à la différentiation
Th1 marquée, ces cellules semblant moins susceptibles à
l’infection par le VIH de par l’induction de facteurs de
restriction dépendants de l’interféron [31].
Conflits d’intérêts : aucun.
274 Virologie, Vol 16, n◦5, septembre-octobre 2012
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = VIR Article Identification = 0459 Date: October 18, 2012 Time: 5:12 pm
éditorial
Références
1. Zhou Y, Callendret B, Xu D, et al. Dominance of the CD4 + T helper
cell response during acute resolving hepatitis A virus infection. J Exp Med
2012 ; 209 : 1481-92.
2. Schulze Zur Wiesch J, Ciuffreda D, Lewis-Ximenez L, et al. Broadly
directed virus-specific CD4 + T cell responses are primed during acute
hepatitis C infection, but rapidly disappear from human blood with viral
persistence. J Exp Med 2012 ; 209 : 61-75.
3. Soghoian DZ, Jessen H, Flanders M, et al. HIV-specific cytolytic CD4 T
cell responses during acute HIV infection predict disease outcome. Sci
Transl Med 2012;4:123ra125.
4. Wilkinson TM, Li CK, Chui CS, et al. Preexisting influenza-specific
CD4 + T cells correlate with disease protection against influenza challenge
in humans. Nat Med 2012 ; 18 : 274-80.
5. Sant AJ, McMichael A. Revealing the role of CD4 + T cells in viral
immunity. J Exp Med 2012 ; 209 : 1391-5.
6. Nepom GT. MHC class II tetramers. J Immunol 2012 ; 188 : 2477-82.
7. Lanford RE, Feng Z, Chavez D, et al. Acute hepatitis A virus infection
is associated with a limited type I interferon response and persistence of
intrahepatic viral RNA. Proc Natl Acad SciUSA2011 ; 108 : 11223-8.
8. Welsh RM, Bahl K, Marshall HD, Urban SL. Type 1 interferons and
antiviral CD8 T-cell responses. PLoS Pathog 2012;8:e1002352.
9. Johnson S, Zhan Y, Sutherland RM, et al. Selected Toll-like receptor
ligands and viruses promote helper-independent cytotoxic T cell priming
by upregulating CD40L on dendritic cells. Immunity 2009 ; 30 : 218-27.
10. Protzer U, Maini MK, Knolle PA. Living in the liver: hepatic infec-
tions. Nat Rev Immunol 2012 ; 12 : 201-13.
11. Stacey AR, Norris PJ, Qin L, et al. Induction of a striking systemic
cytokine cascade prior to peak viremia in acute human immunodeficiency
virus type 1 infection, in contrast to more modest and delayed responses
in acute hepatitis B and C virus infections. J Virol 2009 ; 83 : 3719-33.
12. Neveu B, Debeaupuis E, Echasserieau K, et al. Selection of high-
avidity CD8 T cells correlates with control of hepatitis C virus infection.
Hepatology 2008 ; 48 : 713-22.
13. Rosenberg ES, Billingsley JM, Caliendo AM, et al. Vigorous HIV-1-
specific CD4 + T cell responses associated with control of viremia. Science
1997 ; 278 : 1447-50.
14. Lichterfeld M, Pantaleo G, Altfeld M. Loss of HIV-1-specific T cell
proliferation in chronic HIV-1 infection: cause or consequence of viral
replication? Aids 2005 ; 19 : 1225-7.
15. Appay V, Zaunders JJ, Papagno L, et al. Characterization of CD4 (+)
CTLs ex vivo. J Immunol 2002 ; 168 : 5954-8.
16. Casazza JP, Betts MR, Price DA, et al. Acquisition of direct antiviral
effector functions by CMV-specific CD4 + T lymphocytes with cellular
maturation. J Exp Med 2006 ; 203 : 2865-77.
17. Chakrabarti LA, Simon V. Immune mechanisms of HIV control. Curr
Opin Immunol 2010 ; 22 : 488-96.
18. Ortiz AM, Klatt NR, Li B, et al. Depletion of CD4 (+) T cells abro-
gates post-peak decline of viremia in SIV-infected rhesus macaques. J Clin
Invest 2011 ; 121 : 4433-45.
19. Laguette N, Benkirane M. How SAMHD1 changes our view of viral
restriction. Trends Immunol 2012 ; 33 : 26-33.
20. Malim MH, Bieniasz PD. HIV Restriction factors and mechanisms of
evasion. Cold Spring Harb Perspect Med 2012;2:a006940.
21. Casazza JP, Brenchley JM, Hill BJ, et al. Autocrine production of
beta-chemokines protects CMV-Specific CD4 T cells from HIV infection.
PLoS Pathog 2009;5:e1000646.
22. Zhou L, Chong MM, Littman DR. Plasticity of CD4 + T cell lineage
differentiation. Immunity 2009 ; 30 : 646-55.
23. Swain SL, McKinstry KK, Strutt TM. Expanding roles for CD4 (+) T
cells in immunity to viruses. Nat Rev Immunol 2012 ; 12 : 136-48.
24. Groom JR, Luster AD. CXCR3 ligands: redundant, collaborative and
antagonistic functions. Immunol Cell Biol 2011 ; 89 : 207-15.
25. Yi JS, Cox MA, Zajac AJ. T-cell exhaustion: characteristics, causes
and conversion. Immunology 2010 ; 129 : 474-81.
26. Janssen EM, Droin NM, Lemmens EE, et al. CD4 + T-cell help controls
CD8 + T-cell memory via TRAIL-mediated activation-induced cell death.
Nature 2005 ; 434 : 88-93.
27. Douek DC, Brenchley JM, Betts MR, et al. HIV preferentially infects
HIV-specific CD4 + T cells. Nature 2002 ; 417 : 95-8.
28. Buchbinder SP, Mehrotra DV, Duerr A, et al. Efficacy assess-
ment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a
double-blind, randomised, placebo-controlled, test-of-concept trial. Lan-
cet 2008 ; 372 : 1881-93.
29. Forthal DN, Gabriel EE, Wang A, Landucci G, Phan TB. Association
of Fcgamma receptor IIIa (FcgammaRIIIa) genotype with the rate of HIV
infection following gp120 vaccination. Blood 2012 ; 120 : 2836-42.
30. de Souza MS, Ratto-Kim S, Chuenarom W, et al. The Thai phase
III trial (RV144) vaccine regimen induces T cell responses that preferen-
tially target epitopes within the V2 region of HIV-1 envelope. J Immunol
2012 ; 188 : 5166-76.
31. Vetter ML, Johnson ME, Antons AK, Unutmaz D, D’Aquila RT. Diffe-
rences in APOBEC3G expression in CD4 + T helper lymphocyte subtypes
modulate HIV-1 infectivity. PLoS Pathog 2009;5:e1000292.
Virologie, Vol 16, n◦5, septembre-octobre 2012 275
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
1
/
5
100%