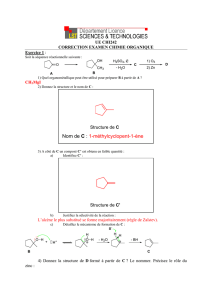
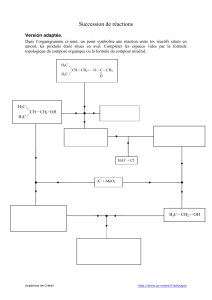
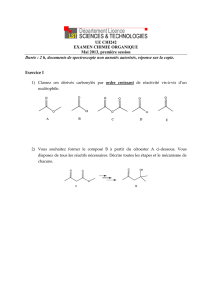
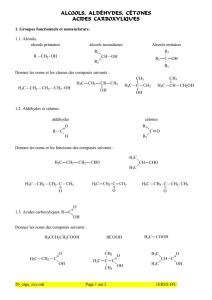
Augmentation du rendement – par limitation des réactions

Partie 2 : Chimie et développement durable
Des synthèses avec de meilleurs
rendements
S.CALLEA
Lycée Gay-Lussac
Programme Term SPCL
23 Mai 2012

Programme de Terminale SPCL
Des synthèses inorganiques
Notions et contenus Capacités exigibles
Transformation
spontanée
et
évolution
d’un système
vers
un
état d’équilibre.
Augmentation
du rendement
de
la
synthèse d’un produit :
Pour une réaction donnée par
:
Elimination d’un produit
Ajout d’un réactif en excès
Modification de la température
Par changement d’un
des
réactifs
Par limitation de
réactions
concurrentes
:
Chimiosélectivité
Régiosélectivité
Stéréosélectivité
Justifier le caractère spontané
d’une
transformation
en comparant le quotient de
réaction
Qr
et la constante d’équilibre K
Déterminer un rendement de synthèse
Inventorier les paramètres qui
permettent
d’améliorer
le rendement d’une synthèse.
Reconnaître entre deux protocoles, le
paramètre
qui
aété modifié et justifier son rôle sur l’évolution
du
rendement
.
Proposer et mettre en œuvre un protocole
pour
illustrer
une amélioration du rendement de synthèse.
Comparer des protocoles de synthèse et choisir
le
plus
performant (rendement, coût, respect
de
l’environnement)
.

Transformation spontanée et évolution d’un système vers un état d’équilibre.
Etude thermodynamique :
La fonction G, enthalpie libre ou fonction de Gibbs est un potentiel
thermodynamique.
Lors d’une évolution spontanée, G ne peut que décroitre : dG < 0
Différentielle de G d’un système avec réaction chimique :
dG = VdP –SdT + rG.doù : avancement de la réaction chimique
rG = enthalpie libre de réaction
r
P,T
G
G
AP, T = const2, (dG)P,T = + rG.d
D’après le critère d’évolution spontanée (dG < 0) + rG.d< 0
Si la réaction avance à P, T = const2, d> 0 rG < 0

Transformation spontanée et évolution d’un système vers un état d’équilibre.
Etude thermodynamique :
Si la réaction avance à P, T = const2, d> 0 rG < 0
Expression de rG:
:
i
0
r r r r i
r
Δ G = Δ G + RTlnQ avec Q = (a )
Q quotient de réaction
ai: activité de l’espèce i hors
équilibre
i: coefficient stœchiométrique de
l’espèce dans l’équation de la
réaction
i> 0 pour un produit
i< 0 pour un réactif

Transformation spontanée et évolution d’un système vers un état d’équilibre.
i
0
r r r r i
Δ G = Δ G + RTlnQ avec Q = (a )
Rappel des activités des espèces :
Si espèce iest un gaz dans un mélange de gaz :
Si espèce iest un soluté dans une solution :
Si espèce iest un solvant ou un solide pur ou un liquide pur :
Si espèce iest en phase condensée (convention mélange)
i
ii
0
0
P
a avec P : pression partielle de l'espèce i
P
P : pression standard = 1 bar
i
ii
0
0 -1
C
a avec C : concentration de l'espèce i
C
C : concentration standard = 1 mol.L
i
a 1
ii
a x : fraction molaire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%