Recommandations sur le traitement du diabète de type 2

Recommandations sur le traitement du diabète de type 2
Déclaration de consensus de la Société Suisse d’Endocrinologie-Diabétologie
Commentaire d’experts suisses au sujet des recommandations communes de l’ADA (American Diabetes Association) et de l’EASD
(European Association for the Study of Diabetes)
Jacques Philippe, Michael Brändle, Jacques Carrel, Peter Diem*, Ulrich Keller, François Kuntschen, Juan Ruiz,
Matthias Stahl, Benno Weissenberger, Giatgen A. Spinas
RECOMMANDAT IONS Forum Med Suisse 2009;9(3):50–55 50
sur la prévention de complications à long terme
sont insuffisantes. Les effets bénéfiques du trai-
tement paraissent être liés en premier lieu au de-
gré de réduction du taux de glycémie. L’étude
UKPDS [4] a comparé trois classes de médica-
ments hypoglycémiants (sulfonylurées, metfor-
mine et insuline), mais cette étude n’a pas pu dé-
montrer la supériorité d’une thérapie par rapport
aux autres, hormis la metformine pour les com-
plications cardiovasculaires.
Le choix des antidiabétiques repose donc sur leur
efficacité sur le contrôle glycémique et leurs au-
tres effets susceptibles de réduire les complica-
tions à long terme, ainsi que sur leur profil de sé-
curité, leur tolérance et leurs coûts.
Effets non glycémiques des antidiabétiques
Outre les effets sur la glycémie, les antidiabé-
tiques oraux peuvent avoir d’autres effets béné-
fiques sur les facteurs de risque cardiovasculaires
tels que sur la pression artérielle et les dyslipidé-
mies. Par ailleurs, il faut tenir compte des effets
susceptibles d’influencer le contrôle de la glycé-
mie à long terme tels que par exemple les varia-
tions du poids corporel, l’insulinorésistance ou la
capacité d’insulinosécrétion.
3. Adaptation des habitudes et du mode de vie
Par une influence positive sur l’hygiène de vie, on
obtient un meilleur contrôle de la glycémie ainsi
qu’une amélioration de la tension artérielle et de
la dyslipidémie. Dans ce contexte, le rôle central
revient à la réduction du poids corporel grâce à
une alimentation équilibrée avec diminution de
l’apport calorique et à une activité physique ac-
crue. La perte de poids étant malheureusement
souvent passagère, les effets bénéfiques de l’adap-
tation des habitudes de vie sur le contrôle de la
glycémie ne sont généralement pas durables. Les
traitements pharmacologiques de l’obésité ne
peuvent actuellement être recommandés en tant
que traitement primaire du diabète sucré, car il
n’existe pas d’études ayant validé ces traitements
par des critères de morbidité et mortalité.
Avant-propos
Pour la première fois, les sociétés américaines et
européennes du diabète ont publiés conjointe-
ment des recommandations pour le traitement de
l’hyperglycémie chez les patients diabétiques de
type 2. Ces recommandations sont disponibles
sous la forme d’un algorithme pour l’initiation et
l’adaptation du traitement antidiabétique [1, 2].
Un groupe d’experts suisses – composé des cinq
responsables du domaine de la diabétologie dans
les hôpitaux universitaires ainsi que de représen-
tants d’autres hôpitaux régionaux et de praticiens –
résume et commente ci-dessous les recomman-
dations de l’ADA et de l’EASD en les adaptant à
la situation en Suisse.
Les recommandations dans le domaine de la
diabétologie reposent en effet non seulement
sur la médecine factuelle qui a ses limites, mais
aussi sur l’opinion d’experts. Les experts suisses,
par la composition équilibrée de leur groupe, pro-
posent une attitude différenciée des traitements
antidiabétiques.
Ce papier se compose de trois parties. La pre-
mière partie résume brièvement les recomman-
dations de l’ADA et de l’EASD, la deuxième partie
contient les commentaires suisses. La troisième
partie constitue un complément suisse et parle de
l’éducation du patient.
I. Résumé des recommandations
de l’ADA et de l’EASD
1. Objectifs glycémiques
Plusieurs études effectuées chez les diabétiques
de type 1 et 2 ont contribué à établir des objectifs
glycémiques permettant d’améliorer la préven-
tion des complications à long terme [3–7]. L’ob-
jectif glycémique recommandé par l’ADA/EASD
est un taux d’HbA1c <7% chez la plupart des pa-
tients, et un taux d’HbA1c le plus proche de la nor-
male (<6%) chez des patients individuels présen-
tant un faible risque d’hypoglycémie.
2. Principes applicables lors du choix
d’un traitement antidiabétique
Les recommandations pour le choix ou l’associa-
tion d’agents antidiabétiques sont restreintes
parce que les données concernant leur influence
*Peter Diem reçoit du soutien de recherche par: GSK,
Novo-Nordisk, Pfizer, Roche Diagnostics. Advisorypanels,
conférences: GSK, MSD, Novartis, Roche Diagnostics,
sanofi-aventis, Takeda.

RECOMMANDAT IONS Forum Med Suisse 2009;9(3):50–55 51
ou, rarement chez le diabétique de type 2, acido-
cétose), le traitement doit dans la mesure du pos-
sible être initié et adapté en ambulatoire. Une
éducation personnalisée du patient joue un rôle
essentiel dans la prise en charge.
L’autocontrôle glycémique est à adapter indivi-
duellement et constitue un outil important pour
le succès thérapeutique, notamment lors de
l’utilisation ou de l’adaptation de la dose de mé-
dicaments susceptibles de provoquer une hypo-
glycémie (sulfonylurées, glinides, insuline). Les
valeurs glycémiques obtenues plusieurs fois par
semaine corrèlent généralement bien avec le taux
d’HbA1c. Lors d’une glycémie à jeun entre 4 et
7 mmol/l, le taux d’HbA1c est généralement lui
aussi dans les objectifs souhaités. Si ce n’est pas
le cas, des contrôles des glycémies post-pran-
diales doivent être effectués 90 à 120 minutes
après le début des repas. Leurs résultats de-
vraient être <8–10 mmol/l.
Algorithme
L’algorithme thérapeutique proposé par l’ADA/
EASD (non illustré; l’algorithme recommandé en
Suisse sera discuté en détail au paragraphe II)
tient compte des critères thérapeutiques indivi-
4. Médicaments
Le tableau 1 pillustre les propriétés des anti-
diabétiques oraux actuellement disponibles, avec
leurs avantages et leurs inconvénients. Les nou-
veaux antidiabétiques seront présentés en détail
dans le chapitre II-4 selon leur disponibilité en
Suisse.
Le choix de la classe de substances dépend de
l’équilibre métabolique. Si l’équilibre métabo-
lique est mauvais (HbA1c >8,5%), il est recom-
mandé d’utiliser un antidiabétique permettant
une réduction plus importante et rapide du taux
de glycémie ou de passer plus rapidement à un
traitement combiné. Par contre, en présence d’un
équilibre métabolique plus proche des valeurs
cibles (HbA1c <7,5%), on considérera aussi des
médicaments moins puissants et/ou plus lents
dans leurs effets hypoglycémiants.
Le diabète de type 2 est une maladie évolutive,
conduisant à une détérioration progressive de
l’équilibre métabolique. L’ajout de médicaments
est la règle.
5. Initiation et adaptation du traitement
A l’exception d’une décompensation hyperglycé-
mique aiguë (hyperglycémie hyperosmolaire
Ta bleau 1. Aperçu des traitements. Les données se réfèrent toujours à la monothérapie.
Interventions Mécanisme d’action Avantages Inconvénients Diminution
de l’HbA1c (%)
Mode de vie pour diminuer Bon marché Effets de courte durée souvent <1 an 1–2
le poids et augmenter Nombreux bénéfices
l’activité physique
Metformine Réduction de la production Absence d’hypoglycémies, Troubles gastro-intestinaux 1–2
hépatique de glucose effet neutre sur le poids, Rarement: acidose lactique
bon marché, effetfavorable (1–3/100 000 patients-année)
sur les complications micro-
et macro-angiopathiques [5]
Sulfonylurées Stimulation de la sécrétion Bon marché Prise de poids, hypoglycémie 1–2
endogène d’insuline (Cave: patients âgés)
Insuline Substitution de l’insuline Le plus efficace, pas de limite Injections, auto-contrôles, hypoglycémies, 1,5–3,5
de dose, bon marché, prise de poids, formations nécessaires
amélioration du profil lipidique
Thiazolidinédiones (TZD) Modulation du PPARg. Effets bénéfiques sur le profil Rétention hydro-sodée, 0,5–1,4
Réduction de l’insulinorésistance lipidique (pioglitazone) prise de poids, risque d’insuffisance
des cellules musculaires, cardiaque et de fracture, prix élevé
adipeuses et hépatiques
Réduction de l’insulinorésistance
Analogues du GLP-1 Stimulation de la sécrétion Perte de poids, absence Injections s.c., effets gastro-intestinaux 0,5–1,0
(exenatide) d’insuline lors d’une augmentation d’hypoglycémies fréquents, peu d’expérience à long terme,
de la glycémie prix élevé; rares cas de pancréatite
Peu d’expérience à long terme, prix élevé
Gliptines (sitagliptine, Inhibition de la DPP-IV,Effets neutres sur le poids, Administration 2 à 3 x/ jour, prix élevé 0,5–0,8
vildagliptine) ainsi dégradation réduite du GLP-1 absence d’hypoglycémies
et du GIP, donc stimulation indirecte
de la sécrétion d’insuline
Glinides Stimulation de la sécrétion Durée d’action courte Effets gastro-intestinaux fréquents, 1–1,5
endogène d’insuline prise 3 x/ j, prix élevé, effet modeste
Inhibiteurs des Retardement de l’absorption Effets neutres sur le poids Effets de courte durée souvent <1 an 0,5–0,8
a-glucosidases de glucose. Réduction de
l’hyperglycémie post-prandiale.
Contrôle de l’appétit,
réduction de l’apport calorique

RECOMMANDAT IONS Forum Med Suisse 2009;9(3):50–55 52
Si cela ne suffit pas pour atteindre les valeurs
cibles d’HbA1c, il faut adapter le traitement mé-
dicamenteux. En présence de taux d’HbA1c >8,5%
ou de symptômes d’hyperglycémie, l’utilisation
d’insuline basale permet le plus efficacement de
réduire le taux de glycémie. Sinon, les opinions
divergent sur la classe thérapeutique (insulines,
sulfonylurées, glitazones) à utiliser en deuxième
intention. La posologie de l’insuline doit être
adaptée aux valeurs de la glycémie. Se reporter
à la figure 1 xpour des informations plus dé-
taillées.
Plusieurs méta-analyses publiées récemment ont
mis en question la sécurité de la rosiglitazone
par rapport au risque d’infarctus du myocarde.
L’augmentation de 30 à 40% du risque potentiel
est basée sur des données pas encore définitives;
elle a néanmoins conduit à la recommandation
de ne pas utiliser la rosiglitazone chez des pa-
tients avec une maladie coronarienne, particu-
lièrement en association avec l’insuline. En ou-
tre, aussi bien la rosiglitazone que la pioglitazone
sont associées à la survenue d’une insuffisance
cardiaque (risque augmenté 2 fois) et de frac-
tures, particulièrement chez la femme.
Lors d’une association de plusieurs classes de
substances, il convient de considérer les avan-
tages, les synergies et les interactions entre les
différentes classes. Lors d’une association d’in-
suline et glitazone, on tiendra compte du risque
accru de rétention liquidienne et d’ischémie car-
diaque.
Traitement hors de l’algorithme
Les complications métaboliques aiguës (cétonu-
rie avec des taux de glycémie à jeun >14,0 mmol/l,
glycémie non à jeun >16,0 mmol/l), avec HbA1c
>10% et symptômes d’hyperglycémie (polyurie,
polydipsie et perte de poids) exigent une utilisa-
tion rapide d’insuline. Dans ces situations, il faut
envisager un diabète de type 1 ou un diabète de
type 2 avec déficit important d’insuline. Dans ce
dernier cas, on songera à évaluer le retour aux
antidiabétiques oraux après normalisation du
métabolisme et de la situation clinique.
II. Commentaires du groupe d’experts
suisses au sujet des recommandations
de l’ADA et de l’EASD
1. Objectifs glycémiques
Un taux d’HbA1c >7%indique généralement un
besoin d’agir et suggère qu’il faut commencer un
traitement ou modifier le traitement en cours.
Chez les patients à faible risque d’hypoglycémie,
nous recommandons de viser des taux d’HbA1c
inférieurs à 6,5%. Deux nouveaux articles portant
sur des patients présentant un risque cardiovas-
culaire accru révèlent qu’une baisse trop agres-
sive de la glycémie (valeur cible: HBA1c <6%) a en-
traîné l’augmentation non seulement du risque
duels, des effets synergiques de traitements as-
sociés et des coûts du traitement. L’objectif des
traitements est d’atteindre aussi rapidement que
possible et de maintenir des taux de glycémie nor-
maux.
L’adaptation du mode de vie constitue la base de
tout traitement du diabète de type 2. Les patients
présentant un syndrome métabolique doivent
par conséquent être conseillés et suivis par des
professionnels compétents (infirmière en diabé-
tologie, diététicienne, psychologue). Sachant que
la mise en œuvre des adaptations du comporte-
ment est généralement difficile, on utilise la met-
formine à la période initiale en l’absence de
contre-indications. Cette mesure thérapeutique
permet de réduire l’hyperglycémie sans entraî-
ner de prise de poids ou d’hypoglycémie. La dose
de metformine doit être augmentée progressive-
ment pour atteindre la dose maximale tolérée en
l’espace d’un à deux mois (environ 2 g/jour en
2–3 prises).
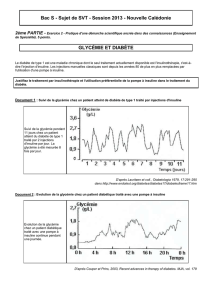
Début avec de l’insuline NPH avant le
coucher ou avec un analogue de longue
durée d’action avant le coucher ou le matin.
Début par ex.avec10 U ou 0,2 U/kg.
Glycémie à jeun chaque jour; augmentation
de la dose de 2 U tous les 3 jours jusqu’à
obtention de la valeur cible de 4 à 7 mmol/l.
Lors d’une glycémie à jeun >10 mmol/l:
augmentation de 4 U tous les 3 jours.
HbA1c 97, 0%
au bout de 2 à 3 mois
Lors d’une glycémie à jeun
<5 mmol/l ou lors d’hypo-
glycémies: réduction de la dose
d’insuline administrée avant le
coucher de 2 U ou de 10%,
si la dose d’insuline est >60 U.
Oui Non
Schéma inchangé,
contrôles du taux
d’HbA1c tous
les 3 mois.
Taux de glycémie
excessif à midi:
ajout d’insuline
rapide avant le
petit-déjeuner.
Si la glycémie à jeun est de 4 à 7 mmol/l, contrôle
de la glycémie à midi, le soir et avant le coucher.
Début avec une insuline rapide (env. 4 U),
augmentation de 2 U tous les 3 jours.
Taux de glycémie
excessif avant le
coucher: ajout
d’insuline rapide
avant le dîner.
Taux de glycémie
excessif le soir:
ajout d’insuline
basale le matin
ou d’insuline
préprandiale
avant le déjeuner.
HbA1c 97, 0%
au bout de 2 à 3 mois
Oui
Contrôle du taux de glycémie avant
les repas; éventuellement administra-
tion d’injections supplémentaires
d’insuline. Si le taux d’HbA1c reste
élevé, contrôle des valeurs post-
prandiales et augmentation des doses
d’insuline préprandiales correspondantes.
Non
Figure 1
Algorithme de l’ADA/EASD pour l’initiation et l’adaptation d’une insulinothérapie.

RECOMMANDAT IONS Forum Med Suisse 2009;9(3):50–55 53
lué définitivement. Les glitazones restent des mé-
dicaments de 2echoix, exigeant une stricte prise
en compte de leurs contre-indications. La rosigli-
tazone est contre-indiquée actuellement chez les
patients avec maladie coronarienne. L’insuline
peut être utilisée à tout moment, sans aucune
contre-indication.
Nouveaux antidiabétiques
Les analogues du glucagon-like peptide 1, les
gliptines et les inhibiteurs des récepteurs canna-
binoïdes (rimonabant) seront en outre abordés ici
en tenant compte du marché suisse.
Selon le tableau 1, les «nouveaux» antidiabé-
tiques tels que les gliptines ou analogues du GLP-1
n’ont pas d’avantage sur la réduction du taux
d’HbA1c comparé aux antidiabétiques «tradition-
nels», avec la limitation due aux différences des
schémas d’étude (comme par ex. valeur initiale
du taux d’HbA1c, médications concomitantes, du-
rée du diabète).
Analogues des glucagon-like peptides: le gluca-
gon-like peptide 1 (GLP-1) est synthétisé par les
cellules L de l’intestin grêle. Il stimule la sécrétion
d’insuline lors d’une augmentation de la glycémie
après un repas. L’exenatide présente une struc-
ture apparentée au GLP-1 humain, mais se dis-
tingue par une demi-vie plus longue. La subs-
tance est injectée 2 fois par jour par voie
sous-cutanée. L’exenatide baisse le taux d’HbA1c
de 0,5 à 1,0%, notamment en réduisant la glycé-
mie postprandiale. En outre, l’exenatide inhibe la
sécrétion de glucagon et retarde la vidange gas-
trique, ne provoque pas d’hypoglycémie, mais est
souvent associée à des effets indésirables gastro-
intestinaux tels que nausées, vomissements et
diarrhées (dans 30 à 45% des cas au début du
traitement). Dans les études cliniques, l’exena-
tide a provoqué une perte de poids de 4 à 5 kg sur
2 ans. En Suisse, l’exenatide (Byetta®) est homo-
loguée pour une utilisation en association avec les
sulfonylurées et/ou la metformine chez des pa-
tients avec un BMI 028 kg/m2.
Gliptines: les gliptines sont des inhibiteurs oraux
de la DPP-4 (dipeptidyl peptidase IV), une enzyme
responsable de la dégradation du GLP-1 et du GIP
(glucose-dependent insulinotropic peptide). Ces
agents augmentent ainsi les taux plasmatiques de
GLP-1 et de GIP. La réduction moyenne du taux
d’HbA1c est de 0,7%. Les gliptines ont peu d’effets
indésirables connus. Januvia®(sitagliptine) et Gal-
vus®(vildagliptine) sont commercialisés en Suisse.
Les inhibiteurs de la DPP-4 n’ont pas d’effet sur
le poids corporel. Le traitement aux analogues du
GLP-1 ou aux gliptines offre une alternative aux
traitements classiques lorsqu’ils ne sont plus as-
sez efficaces ou qu’ils sont mal tolérés. En raison
des incertitudes au sujet de la sécurité à long
terme, ces agents ne doivent être considérés
qu’en 2eou 3eintention.
Rimonabant: le contrôle de l’apport alimentaire et
de la composition du corps sont influencés entre
d’hypoglycémie, mais aussi de la mortalité car-
diovasculaire (étude ACCORD [9] et étude VADT
[non significative, non publiée]). Cet objectif n’est
donc pas souhaitable ou praticable chez tous les
patients. Une appréciation clinique sur la base
des avantages et inconvénients potentiels d’un
traitementintensifié restenécessaire pourchaque
patient. Dans ce cadre, on tiendra compte en par-
ticulier de facteurs tels que l’espérance de vie, le
risque d’hypoglycémie et les comorbidités.
2. Principes applicables lors du choix d’une
intervention visant le contrôle glycémique
Les antidiabétiques seuls ou associés doivent être
évalués principalement sur la base du taux indi-
viduel d’HbA1c et de leurs contre-indications. Par
ailleurs, on tiendra compte des effets indésirables
spécifiques et des coûts. Sur le plan clinique, ce
seront surtout les différents effets des agents an-
tidiabétiques sur le poids corporel qui joueront
un rôle.
3. Adaptation des habitudes et du mode de vie
L’adaptation des habitudes de vie est une mesure
thérapeutique essentielle chez tout diabétique de
type 2. Elle doit être initiée dès le diagnostic d’un
diabète sucré et ne pas être abandonnée au cours
du suivi. L’adaptation des habitudes inclut un ap-
port calorique réduit dans le cadre d’une ali-
mentation saine et équilibrée ainsi qu’un exercice
physique régulier (au moins 150 minutes par se-
maine, réparties sur au moins 3 jours, idéalement
sur 5 à 7 jours), pour atteindre une réduction d’au
moins 5 à 10% du poids corporel initial [9, 10].
Ces mesures permettent initialement une nette
amélioration de la glycémie et une réduction de
l’HbA1c qui peut aller jusqu’à 2% [4]. L’adaptation
du mode de vie a des effets bénéfiques non seule-
ment sur la glycémie, mais aussi sur les facteurs
de risque cardiovasculaires souvent présents
chez ces patients (hypertension, dyslipidémie).
La mise en œuvre pratique de ces recommanda-
tions étant souvent difficile, nous recommandons
des programmes complets pour la réduction non-
chirurgicale du poids et la promotion des activités
physiques. Les différentes mesures d’adaptation
des habitudes ne permettent que chez 10 à 20%
de tous les diabétiques de type 2 un contrôle adé-
quat durable de la glycémie [11]. Par conséquent,
il faut y ajouter suffisamment tôt un traitement
médicamenteux.
4. Médicaments
Antidiabétiques établis
Les médicaments les plus souvent utilisés en
Suisse sont la metformine et les sulfonylurées
qui constituent le traitement combiné de base chez
la plupart des patients. Les inhibiteurs de l’a-glu-
cosidase et les glinides sont rarement utilisés.
Le profil de sécurité cardiovasculaire des glita-
zones, étudié dans plusieurs méta-analyses pu-
bliées récemment, ne peut pas encore être éva-

RECOMMANDAT IONS Forum Med Suisse 2009;9(3):50–55 54
les glinides (repaglinide) peuvent être données en
tant qu’alternative aux sulfonylurées. Les glita-
zones sont recommandées dans des situations
spéciales (par ex. insulinorésistance sévère, risque
d’hypoglycémie) en deuxième intention après la
metformine. A la même place peuvent être utili-
sées les gliptines ou les analogues du GLP-1 (sur-
tout pour empêcher une prise de poids).
S’il faut intensifier un traitement associant met-
formine et sulfonylurée, on a le choix – outre l’ad-
ministration d’insuline – entre les glitazones et
tous les nouveaux antidiabétiques.
Algorithme pour l’initiation et l’adaptation
d’une insulinothérapie
Algorithme simplifié et souvent utilisé en Suisse
(selon le principe treat-to-target) avec une insu-
line basale:
–Début avec 10 U ou 0,2 U/kg, injection une fois
par jour (en Suisse on commence plus souvent
par 10 U que par 0,2 U/kg par jour).
–Mesure quotidienne de la glycémie à jeun et
calculhebdomadairede la moyenneglycémique
des trois derniers jours.
–Si la moyenne est entre 5 et 7 mmol/l: aucune
modification de la dose d’insuline.
–Si la moyenne est entre 7 et 9 mmol/l: + 2 U
d’insuline basale.
–Si la moyenne est entre 9 et 11 mmol/l: + 4 U
d’insuline basale.
–Si la moyenne est entre 11 et 13 mmol/l: + 6 U
d’insuline basale.
–Si la moyenne est supérieure à 13 mmol/l: + 8
U d’insuline basale.
–Si la moyenne est inférieure à 5 mmol/l (risque
d’hypoglycémie): – 2 U d’insuline basale.
Si après titration de l’insuline basale les taux de
glycémie préprandiales restent élevés (>8 mmol):
ajouter un analogue d’insuline rapide (Huma-
log®, Novorapid®ou Apidra®) avant les repas
principaux (par ex. 3 fois par jour):
–Début avec 4 U préprandial.
–Augmenter la dose au cours du traitement si
les taux de glycémie préprandiales sont:
–>11 mmol/l: + 3 U
–8–11 mmol/l: + 2 U
–>5,5 – <8 mmol/l: pas de titration supplé-
mentaire
III. Education du patient
(patient empowerment)
Généralités
L’éducation du patient est un élément essentiel du
traitement antidiabétique. Dans le cadre de l’édu-
cation du patient, on distingue deux façons de pro-
céder: l’éducation individuelle et l’éducation en
groupe. Pour être efficace, elle doit être faite par
des professionnels disposant d’une formation
spécifique dans ce domaine. Cette mesure doit
aider le patient à gérer lui-même sa maladie et son
autres par le système endocannabinoïde. En tant
qu’antagoniste du récepteur cannabinoïde de
type 1, le rimonabant agit sur le centre hypotha-
lamique du contrôle de l’appétit et réduit l’apport
calorique; il pourrait aussi augmenter la lipolyse.
Dans l’étude RIO Diabetes, le rimonabant a per-
mis une réduction du poids de 3,9 kg sur une an-
née et une amélioration du profil lipidique. Par
rapport à la valeur initiale de 7,3%, le taux
d’HbA1c a pu être réduit en moyenne de 0,6%. Les
effets indésirables sont les nausées (12%) et des
troubles anxieux (1,0% vs 0.3% sous placebo) et
dépressifs (3,0% vs 1.3% sous placebo).
Le rimonabant a été retiré du marché suisse et
mondial pour ses effets secondaires (anxiété, dé-
pression).
5. Initiation et adaptation du traitement
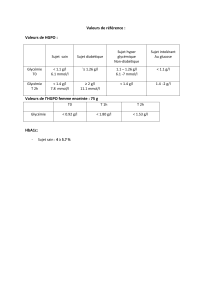
Notre algorithme est basé sur les recommandations
de l’ADA/EASD. De plus, il contient les nouvelles
classes qui sont intéressantes car elles sont neutres
ou elles diminuent le poids corporel et le risque
d’hypoglycémie est réduit ou absent (fig. 2 x). Les
modifications suivantes ont été apportées:
En deuxième intention après la metformine, nous
recommandons en principe des sulfonylurées ou
de l’insuline basale. En cas d’insuffisance rénale,
Figure 2
Schéma suisse pour le traitement du diabète de type 2:
+Approche éprouvée;
*surtout en cas d’insuffisance rénale;
** en cas de risque d’hypoglycémie, d’insuffisance rénale, d’insulinorésistance sévère, ou pour
empêcher une prise de poids (voir tableau 1 pour plus de détails).
Ajouter:
Glitazone ou
gliptine ou
analogue du GLP-1
Modification du mode
de vie plus metformine
HbA1c >7%
HbA1c >7%
HbA1c >7%
Insulinothérapie intensifiée
Pour des situations
spéciales**
glitazone ou
gliptine ou analogue
du GLP-1
Ajouter:
sulfonylurée
(ou glinide*)
Symptômes d’une hyperglycémie/décompensation
HbA1c >8,5%
Ajouter l’insuline basale
(le plus efficace)
HbA1c >7%
Ajouter:
Sulfonylurée
Etape 1
Etape 2
(ou 1re intention
en cas d’intolérance
à la metformine)
+
 6
6
1
/
6
100%