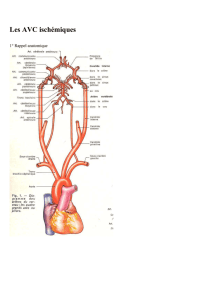
Évènements de vie : rôle dans la survenue d`un infarctus cérébral et

´
Ev`enements de vie : rˆole dans la survenue d’un infarctus
c´er´ebral et d’une d´epression post-AVC
Vincent Guiraud
To cite this version:
Vincent Guiraud. ´
Ev`enements de vie : rˆole dans la survenue d’un infarctus c´er´ebral et d’une
d´epression post-AVC. M´edecine humaine et pathologie. Universit´e Ren´e Descartes - Paris V,
2012. Fran¸cais. <NNT : 2012PA05S007>.<tel-00715171>
HAL Id: tel-00715171
https://tel.archives-ouvertes.fr/tel-00715171
Submitted on 6 Jul 2012
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.

1
UNIVERSITE PARIS 5 - RENE DESCARTES
ECOLE DOCTORALE 420 SANTE PUBLIQUE
Année 2012 N° Bibliothèque
|__|__|__|__|__|__|__|__|__|__|
THESE
pour obtenir le grade de
DOCTEUR EN SANTE PUBLIQUE
Spécialité : Recherche Clinique
présentée par
Vincent GUIRAUD
Évènements de vie : rôle dans la survenue d’un infarctus
cérébral et d’une dépression post-AVC.
Directeur de thèse : Professeur Jean-Louis MAS
Soutenue le 6 Juin 2012
JURY
Monsieur le Professeur Gilles Chatellier
Monsieur le Professeur Philippe Fossati (Rapporteur)
Monsieur le Professeur Didier Leys (Rapporteur)
Monsieur le Professeur Jean-Louis Mas (Directeur)

2
UNIVERSITE PARIS 5 - RENE DESCARTES
ECOLE DOCTORALE 420 SANTE PUBLIQUE
Année 2012 N° Bibliothèque
|__|__|__|__|__|__|__|__|__|__|
THESE
pour obtenir le grade de
DOCTEUR EN SANTE PUBLIQUE
Spécialité : Recherche Clinique
présentée par
Vincent GUIRAUD
Évènements de vie : rôle dans la survenue d’un infarctus
cérébral et d’une dépression post-AVC.
Directeur de thèse : Professeur Jean-Louis MAS
Soutenue le 6 Juin 2012
JURY
Monsieur le Professeur Gilles Chatellier
Monsieur le Professeur Philippe Fossati (Rapporteur)
Monsieur le Professeur Didier Leys (Rapporteur)
Monsieur le Professeur Jean-Louis Mas (Directeur)

3
Remerciements
Je remercie tout particulièrement le Professeur Jean-Louis Mas de m’avoir fait confiance en
me proposant cette recherche, de m’avoir soutenu tout au long de ces années et d’avoir dirigé
ce travail de thèse. Je le remercie de sa patience, de m’avoir fait part de sa très grande
expérience et de m’avoir transmis sa rigueur scientifique, qualité indispensable pour publier
dans des revues scientifiques de qualité. J’espère avoir acquis les bases nécessaires pour
conduire de nouvelles études.
Je remercie également le Professeur Emmanuel Touzé d’avoir dirigé une partie de ce travail
de thèse. Depuis mes premières années d’internat en passant par ma thèse de médecine, il n’a
cessé de m’encourager et de me soutenir pour la recherche. A son contact, j’ai acquis de
nombreuses connaissances en épidémiologie et surtout dans le domaine statistique. Je le
remercie de son soutien au quotidien, de son écoute attentive et de son amitié.
Je remercie le Professeur Gilles Chatellier de l’honneur qu’il m’a fait en acceptant de
participer à ce jury de thèse. Son expérience nous démontre chaque jour l’importance de
l’épidémiologie clinique dans nos travaux de recherche.
Je remercie les rapporteurs, le Professeur Didier Leys et le Professeur Philippe Fossati, qui
ont bien voulu lire et analyser cette thèse. Je les remercie de la qualité de leurs commentaires.
Je remercie bien sûr, David Calvet, compagnon de thèse et ami, avec qui j’ai partagé les
épreuves et les joies de la thèse. Je remercie également mes collègues de travail, Catherine
Lamy, Valérie Domigo qui m’ont soutenu pour que je mène à bien ce travail de thèse. Je

4
remercie également Catherine Lamy qui avait rédigé avant moi une première version du
protocole de l’étude DEPRESS.
Je remercie les psychiatres de Sainte-Anne, Pr Frédéric Rouillon (CMME), Dr Christian Even
(CMME), Dr Jacques Thuile (CMME), Dr Guillaume Lavoisy (CMME), Dr Thierry Gallarda
(SHU), Dr Isabelle Fabre (SHU), qui ont participé à l’étude DEPRESS et sans qui ce travail
n’aurait jamais pu aboutir. Je remercie également le Pr Rouillon pour son aide et ses conseils
dans l’élaboration initiale du projet.
Je remercie Valérie Vignaud, orthophoniste du service de Neurologie, qui a évalué
systématiquement tous les patients aphasiques de l’étude DEPRESS aussi bien à l’inclusion
que lors des visites de suivi. Je la remercie pour sa disponibilité, sa gentillesse et sa
compétence.
Je remercie le Professeur Catherine Oppenheim pour son expertise précieuse dans l’analyse
des données neuroradiologiques.
Je remercie toute ma famille pour leur soutien et leur réconfort tout au long de ces années de
thèse et en particulier mon père dont j’ai essayé de suivre l’exemple. Je remercie enfin mon
épouse, Hélène, qui m’a donné un fils magnifique, Victor, m’a supporté dans les périodes
difficiles et a accepté sans se plaindre des longs week-ends et des soirées de travail.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
1
/
120
100%